تجربة استهلالية
تفاعل بعض الفلزات مع حمض الهيدروكلوريك HCl
المواد والأدوات: شريط مغنيسيوم طوله حبيبات الخارصين Zn، حبيبات الألمنيوم Al،سلك نحاس Cu، محلول حمض الهيدروكلوريك HCl تركيزه ، أنابيب اختبار عدد (4)، حامل أنابيب اختبار، مخبار مدرج ُ ، ورق صنفرة.
إرشادات السلامة: ِ أتبع إرشادات السلامة العامة في المختبر.أرتدي معطف المختبر و النظارات الواقية والقفازات.أتعامل مع الحمض بحذر.
خطوات العمل:
1- أُحضر 4 ِّ أنابيب اختبار نظيفة وجافة وأرقُمها من (1-4) وأضعها على حامل الأنابيب.
2-أقيس. ُ أضع ُ باستخدام المخبار المَدَّرج mL 10 من حمض الهيدروكلوريك HCl في كل أنبوب.
3- الاحظ.أنظف ً شريط المغنيسيوم جيدا باستخدام ورق الصنفرة. ثم أضعه في أنبوب الاختبار رقم (1) ُّ وأرجه بلطف. هل حدث تفاعل؟ ما الدليل على حدوثه؟ َأسجل ملاحظاتي في جدول البيانات.
4-أجرب.أكرر الخطوات السابقة باستخدام حبيبات الخارصين وحبيبات الألمنيوم وسلك النحاس.هل حدث تفاعل؟ هل تختلف الفلزات في نشاطها في التفاعل مع الحمض؟ أسجل ملاحظاتي في جدول البيانات.
5-أنظم البيانات. أسجل ملاحظاتي حول تفاعل الفلزات المستخدمة مع حمضHCl :
Mg: يتفاعل / يتفاعل/ أنشط
Zn: يتفاعل/يتفاعل/ أقل نشاط
Al: يتفاعل/يتفاعل/أنشط
Cu: لا يتفاعل/ لا يتفاعل/ غير نشط
التحليل والاستنتاج:
1- Mg , Zn , Al
2-
تغير اعداد التأكسد : المغنيسيوم من صفر الى 2+ ، الألمنيوم من صفر إلى 3+ ، الخارصين من صفر غلى 2+
مفهوم التأكسد والاختزال Oxidation and Reduction Concept
تهتم الكيمياء الكهربائية Electrochemistry كأحد فروع الكيمياء بدراسة التحولات بين الطاقة الكيميائية والكهربائية الناتجة عن تفاعلات التأكسد
والاختزال والتطبيقات العملية المرتبطة بها.
وتعدُّ تفاعلات التأكسد والاختزال من التفاعلات الكيميائية المهمّة التي تحدث في بعض العمليات الحيوية، كالبناء الضَّوئي والتنفس وتحرير الطاقة من الغذاء اللازم لأداء الكائن الحي أنشطته المختلفة. وتحصل وسائل النقل على الطاقة اللازمة لتسييرها بحرق الوقود عن طريق تفاعلات تأكسد واختزال أيضًا، وينتج صدأ الحديد عن تفاعلات تأكسد واختزال تحدث عند تعرّض الحديد للهواء الجوي الرطب.
الحيوية، كالبناء الضَّوئي والتنفس وتحرير الطاقة من الغذاء اللازم لأداء الكائن الحي أنشطته المختلفة. وتحصل وسائل النقل على الطاقة اللازمة لتسييرها بحرق الوقود عن طريق تفاعلات تأكسد واختزال أيضًا، وينتج صدأ الحديد عن تفاعلات تأكسد واختزال تحدث عند تعرّض الحديد للهواء الجوي الرطب.
فما المقصود بالتأكسد والاختزال؟
وكيف تُوازن معادلاتُ التأكسد والاختزال بطريقة نصف التفاعل؟
استخدم الكيميائيون القدامى مصطلح التأكسد لوصف تفاعل المادة مع الأكسجين، ومصطلح الاختزال لوصف نزع الأكسجين من المادة، كما يوضِّح التفاعل الآتي:
2Fe2O3(s) + 3C(s) → 3CO2(g) + 4Fe(s)
فالكربون تأكسد لأنه ارتبط بالأكسجين، أمّا أُكسيد الحديد III فقد اختزُل بسبب نزع الأكسجين .
ويبيِّنُ الشكل ( 1) الحديد الناتج عن عملية الاختزال.
ومع مرور الوقت، تطوُّرَ مفهوم التأكسد والاختزال ليشمل تفاعلاتٍ أخرى لا تتضمَّن التفاعل مع الأكسجين فظهر مفهوم جديد للتأكسد والاختزال:
التأكسد Oxidation بأنه فَقْدُ المادة للإلكترونات خلال التفاعل الكيميائي،
أمّا الاختزالُ Reduction فهو كسبُ المادة للإلكترونات خلال التفاعل الكيميائي.
وَتُعَدُّ عمليتا التأكسد والاختزال متلازمتين تحدث إحداهما مع حدوث الأخرى،
ويسمّى التفاعلُ الذي تحدث فيه عمليتا التأكسد والاختزال معًا تفاعلَ تأكسد واختزال .Redox Reaction
فكيف تُحدَّد المادةُ التي تأكسدت والمادة التي اختزلت في التفاعل؟
فمثلا، يتفاعل الكالسيوم مع غاز الكلور حسب المعادلة:
Ca(s) + Cl2(g) → CaCl2(s)
يلاحظ أنَّ كلًّ من الكالسيوم والكلور في المواد المتفاعلة مُتَعادِلا الشحنة، وأنَّ مركَّبَ كلوريد الكالسيوم الناتج CaCl2 مركَّبٌ أيوني تكوُّن من اتحاد أيون الكالسيوم الموجب +Ca 2 وأيوني الكلوريد السالبين -2Cl ، اللّذَيْن تكوَّنا نتيجة تأكسد ذرّة الكالسيوم بفقد إلكترونين واختزال ذرتي الكلور في جزيء الكلور Cl2 بحيث تكسب كلُّ ذرّة منه إلكترونًا واحدًا.
ويمكن كتابة معادلة التفاعل السابقة على شكل نصفي تفاعل؛ حيث يوضِّح نصف التفاعل Half Reaction فقدَ الإلكترونات خلال عمليّة التأكسد، أو اكتسابها خلال عمليّة الاختزال كما يأتي:
نصف تفاعل/ تأكسد: -Ca → Ca2+ + 2e
نصف تفاعل/ اختزال: -Cl2 + 2e- → 2Cl
ألاحظ أنَّ عدد الإلكترونات المفقودة خلال عمليّة التأكسد يساوي عدد الإلكترونات المكتسبة خلال عمليّة الاختزال.
المثال 1
يتفاعل الحديد مع محلول كبريتات النحاس(II) حسب المعادلة:
Fe(s) + CuSO4(aq) → Cu(s) + FeSO4(aq)
أُحَدِّدُ الذرّة أو الأيون الذي تأكسد أو اختُزل في التفاعل، وأكتبُ أنصافَ تفاعلات التأكسد والاختزال.
الحل:
أكتبُ معادلة أيونيّة تمثِّلُ التفاعل.
(Fe(s) + Cu2+ (aq) → Cu(s) + Fe2+ (aq
الاحظ أن ذرّات الحديد المتعادلة تأكسدت بفقد إلكترونين متحولة لأيونات الحديد الموجبة +Fe2 حسب المعادلة:
نصف تفاعل التأكسد:
Fe(s) → Fe2+ (aq) + 2e-
وأما أيونات النحاس + Cu2 فقد اختُزلت بكسب إلكترونين متحوِّلَةً لذرّات النحاس المتعادلة، كما في المعادلة الآتية:
نصف تفاعل الاختزال:
(s)Cu2+(aq) + 2e- → Cu
أتحقَّقُ:
1- أُحَدِّد الذرّات أو الأيونات التي تأكسدت أو اختُزلت في التفاعلات الآتية:
2K(s) + Br2(l) → 2KBr(s)
تأكسد ذرة البوتاسيوم وتحولها إلى أيون موجب، واختزال ذرة البروم وتحولها إلى أيون سالب.
C(s) + O2(g) → CO2(g)
تأكسد الكربون لارتباطه بالأكسجين واختزل الأكسجين
2- أكتبُ نصفَ تفاعل التأكسد ونصفَ تفاعل الاختزال للتفاعل الآتي:
2H+(aq) + Zn(s) → Zn2+(aq) + H2(g)
نصف تفاعل التاكسد: -Zn(s) → Zn2+(aq) + 2e
نصف تفاعل الاخنزال: 2H+(aq) + 2e- → H2(g)
عدد التأكسد Oxidation Number
ما المقصود بعدد التأكسد؟
لا تقتصر تفاعلات التأكسد والاختزال على تكوين مركَّبات أيونيّة فقط، بل تتضمَّن أيضًا تكوين مركَّبات جزيئيَّة ترتبط ذرّاتُ عناصرها بروابطَ تساهميّة؛
إذ لا تحدث فيها عمليّة فقدٍ وكسبٍ للإلكترونات بشكل كلي.
فمثلً، يتفاعل غاز الهيدروجين مع غاز الكلور لتكوين غاز كلوريد الهيدروجين حسب المعادلة:
حسب المعادلة:
( H2(g) + Cl2(g) → 2HCl(g
الرابطة بين ذرَّتي الهيدروجين رابطةٌ تساهميَّة غير قطبيَّة، وكذلك الرابطة بين ذرَّتي الكلور،
أمّا بالنسبة إلى كلوريد الهيدروجين فإنَّ الرابطة بين ذرَّتي الكلور والهيدروجين رابطةٌ تساهميَّة قطبيَّة،
ولأنَّ السالبيَّة الكهربائيَّة للكلور أعلى من الهيدروجين يكون زوجُ الإلكترونات الرابطةِ بين الذرَّتين مُزاحًا باتجاه ذرّة
الكلور دون أن يحدث له انتقال كُلِّي، فتظهر على ذرّة الهيدروجين شحنةٌ جزئيَّة موجبة،
ويظهر على ذرّة الكلور شحنةٌ جزئيَّة سالبة، كما يوضِّح الشكل ( 2).
ولأنَّ التعريف السابق للتأكسد والاختزال لم يشمل التفاعلاتِ التي لا يحدث فيها انتقالٌ كُلِّي للإلكترونات بين الذرّات،
فقد وضع العلماءُ مفهومًا جديدًا يمكن من خلاله تفسيرُ جميع تفاعلات التأكسد والاختزال، وهو عدد التأكسد.
يعرَّفُ عددُ التأكسد Oxidation Number بأنه الشحنة الفعليَّة لأيون الذرّة في المركَّبات الأيونيَّة،
أمّا في المركَّبات الجزيئيَّة فيعرَّفُ بأنه الشحنة التي يفترض أن تكتسبها الذرّة المكوِّنة للرابطة التساهميَّة مع ذرّة أخرى فيما لو انتقلت إلكتروناتُ
الرابطة كُلِّيًّا إلى الذرّة التي لها أعلى سالبيَّة كهربائيَّة.
وبناء عليه يكون عددَ تأكسد الهيدروجين ( 1+) وعدد تأكسد الكلور ( 1-).
فكيف يمكن حساب عدد التأكسد للذرات المختلفة؟
قواعد أساسية لحساب أعداد التأكسد Basic Rules to Assign Oxidation Numbers
ولمعرفة أعداد التأكسد لذرّات العناصر المختلفة والتغيُّرات التي تحصل لها في تفاعلات التأكسد والاختزال وُضعت مجموعة من القواعد لحسابها، يتضمَّنُها الجدول (1) الآتي:
|
الرَّقْمُ |
قواعدُ حساب أعداد التأكسد |
مثال |
عددُ التأكسد |
| 1. | عدد تأكسد ذرّة العنصر الحُرِّ يساوي صفرًا، سواء وُجِدَ على شكل ذرّات أو جُزيئات. |
C N2 S8 |
صفر صفر صفر |
| 2. | عدد تأكسد الأيون أُحادي الذرّة يساوي شحنة هذا الأيون. |
Cu2+ -Br |
2+ 1- |
| 3. | عدد تأكسد عناصر المجموعة الأولى AI وعناصر المجموعة الثانية IIA وعنصر الألمنيوم في جميع مركَّباتها يساوي: 1+، 2+، 3+ على الترتيب. |
Li في Li2O Ca في CaO Al في AlF3 |
+1 +2 3+ |
| 4. | عدد تأكسد الهيدروجين في معظم مركَّباته (1+)، ما عدا عندما يرتبط مع الفِلِزّات مكوِّنًا هيدريد الفِلِزّ، فيكون حينئذ (1-). |
H في HF H في NaH H في BaH2 |
+1 -1 1- |
| 5. | عدد تأكسد الأكسجين في معظم مركَّباته (2-)، ما عدا فوق الأكاسيد، فيكون حينئذ (1-)، وعندما يرتبط مع الفلور يكون موجبا. |
O في H2O O في K2O2 O في OF2 |
-2 -1 +2 |
| 6. |
عدد تأكسد الفلور في جميع مركَّباته يساوي (1-)، وعدد تأكسد الهالوجينات Cl، Br، I في معظم مركَّباتها يساوي (1-)، أما إذا ارتبط أي منها مع الأكسجين أو مع هالوجين سالبيته الكهربائية أعلى فيكون عدد تأكسده موجبًا.وترتيبها حسب السالبية الكهربائية: Cl> Br> I |
F في NaF I في Kl Cl في ClF BrفيHBrO2 |
-1 -1 +1 3+ |
| 7. | مجموع أعداد التأكسد لجميع ذرّات أو أيونات العناصر المكوِّنة للمركَّب المتعادل يساوي صفرًا. | ||
| 8. | مجموع أعداد التأكسد لجميع ذرّات العناصر المكوِّنة لأيون متعدِّد الذرّات يساوي شحنة هذا الأيون. |
المثال 2
أُحَدِّدُ عدد التأكسد لذرّة عنصر الكبريت في المركَّبات أو الأيونات الآتية:
أ ) O2 S ب) Na2SO4 جـ) HS-
الحل
لحساب عدد التأكسد لذرّة العنصر المطلوب، أكتب الصيغة الكيميائيَّة للمركَّب أو الأيون،
ثمَّ أُحَدِّدُ بناءً على القواعد الواردة في الجدول أعدادَ تأكسد ذرّات العناصر المعلومة،
ثمَّ أُطَبِّقُ القاعدة رقم 7، أو القاعدة رقم 8 إذا كانت الصيغة تمثِّلُ أيونًا.
أ)
عدد ذرّات الأكسجين في المركَّب 2، وعدد تأكسد كلِّ ذرّة أكسجين يساوي 2- (حسب القاعدة 5 ) ،
وعدد ذرّات الكبريت في المركَّب 1، والمطلوب حساب عدد تأكسد الكبريت فيه،
حسب القاعدة 7 : مجموع أعداد التأكسد لجميع ذرّات العناصر الداخلة في تكوين المركَّب يساوي صفرًا؛ أي أنَّ:
(عدد تأكسد الأكسجين × عدد ذرّات الأكسجين) + (عدد تأكسد الكبريت × عدد ذرّات الكبريت) = صفرًا
(oxidation No of O × No of atoms of O) + (oxidation No of S × No of atoms of S) = 0
(Noxid O × NO atoms) + (Noxid S × NS atoms) = 0
(-2 × 2) + (Noxid S × 1) = 0
Noxid S = +4
أي أنَّ عدد تأكسد الكبريت = 4+
ب)
أُلاحِظُ أنَّ الصيغة تُمَثِّلُ مُرَكَّبًا متعادلاً. وعليه، أُطَبِّقُ القاعدة 7:
(Noxid Na × NNa atoms) + (Noxid S × NS atoms) + (Noxid O × NO atom) = 0
(+1 × 2) + (Noxid S × 1) + (-2 × 4) = 0
Noxid S = +6
ج)
يلاحظ أنَّ المادة هي أيون شحنته 1- وعليه، أُطَبِّقُ القاعدة 8:
(Noxid H × N H atom) + (Noxid S × N S atom) = -1
(+1 × 1) + (Noxid S × 1) = -1
Noxid S = -2
يلاحظ أنَّ لعنصر الكبريت في مركَّباته السابقة أعدادَ تأكسد 4+ ، 6+ ، 2- بالترتيب؛
ما يعني أنه قد يكون لذرّات العنصر الواحد أكثر من عدد تأكسد في مركَّباته أو أيوناته المختلفة.
مثال 3
أحسبُ عدد التأكسد لذرّة العنصر الذي تحته خطٌّ في المركَّبات أو الأيونات الآتية:
أ) ب) ج) د(
الحل:
أ)
ب)
ج)
د)
اجابة سؤال أتحقَّق. أُحِدِّدُ عدد التأكسد لذرّة العنصر الذي تحته خطٌّ في كلٍّ منَ المركَّبات أو الأيونات الآتية:
P4 ، Cr(OH)3 ، PO43- ، AlH3 ، FeCl3 ، HClO4 ، H3IO62-
التغيُّر في أعداد التأكسد Changes of Oxidation Numbers
يُستفاد من حساب أعداد التأكسد في معرفة ذرّات أو أيونات العناصر التي تأكسدت أو اختُزلت في تفاعلات التأكسد والاختزال.
فكيف يمكن معرفة ذرات أو أيونات العناصر التي تأكسدت أ والتي اختزلت ؟
فمثلاً، يتفاعل النحاس مع محلول نترات الفضّة مكوِّنًا محلولَ نترات النحاس، وتترسَّبُ الفضّة وفقَ المعادلة الأيونيَّة الآتية:
2Ag+ (aq) + Cu(s) → Cu2+(aq) + 2Ag(s)
لمعرفة الذرّات أو الأيونات التي تأكسدت أو اختُزلت سيجري حسابُ أعداد التأكسد وملاحظة التغيُّر فيها.
ألاحظ نقصانُ عدد التأكسد لأيون الفضة +Ag من ( 1+ ← 0)، وزيادة عدد تأكسد ذرة النحاس Cu من ( 0 ← 2+).
في تفاعلات التأكسد والاختزال يدلُّ النقص في عدد التأكسد على حدوث عمليَّة اختزال،
وتدلُّ الزيادة في عدد التأكسد على حدوث عمليَّة تأكسد؛ أي أنَّ
أيونات الفضّة +Ag في التفاعل قد اختُزلت، أمّا ذرّات النحاس Cu فقد تأكسدت،
ويمكن توضيح ذلك باستخدام أنصاف تفاعلات التأكسد والاختزال كالآتي:
نصف تفاعل التأكسد/ زيادة في عدد التأكسد:
Cu(s) → Cu2+(aq) + 2e-
نصف تفاعل الاختزال/ نقصان في عدد التأكسد:
2Ag+(aq) + 2e- → 2Ag(s)
أي أنَّ تغيُّرًا في أعداد التأكسد يحدث في تفاعلات التأكسد والاختزال؛
فزيادة أعداد التأكسد تحدثُ لذرّات أو أيونات العناصر التي تتأكسد،
أمّا نقصانُ أعداد التأكسد فيحدثُ لذرّات أو أيونات العناصر التي تختزل، والمثال ( 4) يوضِّح ذلك.
المثال 4 : أُحَدِّدُ الذرّات التي تأكسدت والذرّات التي اختُزلت في التفاعل الآتي:
SO2(g) + Br2(aq) + 2H2O(l) → 2HBr(aq) + H2SO4(aq)
الحل:
1- أُحَدِّدُ أعداد التأكسد لجميع الذرّات في المواد المتفاعلة والناتجة:
2- أُحَدِّدُ التغيُّرَ في أعداد التأكسد:
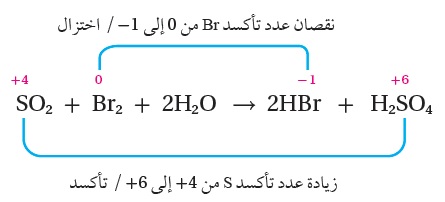
أُلاحظ تغيُّرَ عدد تأكسد ذرّة الكبريت S من (4+ ← 6+)؛ أي أنه زاد بمقدار 2، ومن ثَمَّ فإنَّ الكبريت تأكسد،
وكذلك تغيُّرَ عدد تأكسد ذرة البروم Br من (صفر ← 1-)؛ أي أنه قلَّ بمقدار 1 لكلِّ ذرّة بروم، ومن ثَمَّ فإنَّ البروم اختُزِل،
كما أُلاحظ عدم تغيُّرِ أعداد تأكسد كلٍّ من ذرات الهيدروجين والأكسجين في التفاعل،
ومن ثَمَّ فإنَّ الذرّة التي تأكسدت هي الكبريت في SO2 ، والتي اختُزلت هي ذَرَّتا البروم فيBr2
أتحقَّق. أُحَدِّدُ الذرات التي تأكسدت والذرّات التي اختُزلت اعتمادًا على التغيُّر في أعداد التأكسد في التفاعلات الآتية:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) -1
قل عدد التأكسد O من 0 الى 2- اي انه اختزل ، زاد عدد التأكسد C من 4- الى 4+ اي انه تأكسد
SiCl4(l) + 2Mg(s) → 2MgCl2(s) + Si(s) -2
قل عدد التأكسد S من 4+ الى 0 اي انه اختزل ، زاد عدد التأكسد Mg من 0 الى 2+ اي انه تأكسد
العوامل المؤكسدة والعوامل المُختزلة Oxidizing Agents and Reducing Agents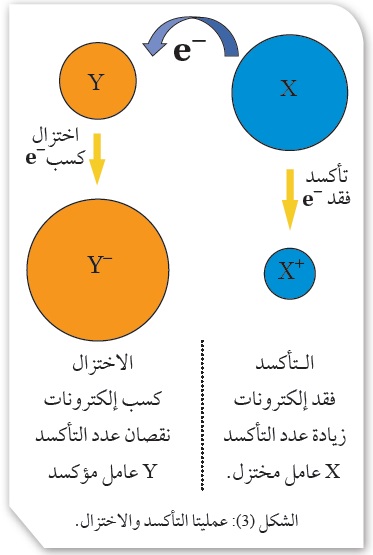
يعرَّفُ العاملُ المؤكسد Oxidizing Agent بأنه المادةُ التي تُؤكسد مادةً أخرى في التفاعل الكيميائي،
فيكتسب إلكترونات من المادة التي يُؤكسدها وتحدث له عمليَّة اختزال.
ومنَ الأمثلة على العوامل المؤكسدة : F2 ، K2Cr2O7 ، KMnO4 ، O2
ويعرَّفُ العاملُ المختزل Reducing Agent بأنه المادةُ التي تَختزل مادةً أخرى في التفاعل الكيميائي؛
إذ يفقد إلكترونات تكسبها المادةُ التي يَختزلُها وتحدث له عمليَّة تأكسد.
ومنَ الأمثلة على العوامل المختزلة : CO ، NaBH4 ، LiAlH4
ومن ثَمَّ فكلُّ تفاعل تأكسد يحتاج إلى عامل مؤكسد ليحدث، وكل تفاعل اختزال يحتاج إلى عامل مختزل ليحدث.
ويوضِّح الشكلُ ( 3) عمليَّتي التأكسد والاختزال، والأمثلة الآتية توضِّح كيفيَّة تحديد العامل المؤكسد والعامل المختزل.
المثال 5 : يُعَدُّ تفاعلُ الثيرمايت أحدَ تفاعلات التأكسد والاختزال المهمّة؛ حيث يتفاعل الألمنيوم مع أكسيد الحديد III لتكوين
أكسيد الألمنيوم والحديد وكمية كبيرة من الطاقة كافية لصهر الحديد الناتج، حسب المعادلة:
2Al(s) + Fe2O3(s) → 2Fe(l) + Al2O3(s) + heat
أُحَدِّدُ العاملَ المؤكسد والعامل المختزل في التفاعل.
الحل:
1 - لتحديد العامل المؤكسد والعامل المُختزل أبدأ بتحديد أعداد التأكسد لجميع الذرّات أو الأيونات في التفاعل:
0 +3 -2 0 +3 -2
2Al(s) + Fe2O3(s) → 2Fe(l) + Al2O3(s)
2 - أُحَدِّدُ التغيُّرَ في أعداد التأكسد:
0 +3 0 +3
2Al(s) + Fe2O3(s) → 2Fe(l) + Al2O3(s)
ألاحظ أنَّ عدد تأكسد ذرات الألمنيوم Al زاد ( 0 ← 3+)؛ أي أنها تأكسدت،
أمّا عددُ تأكسد أيونات الحديد +3 Fe في أكسيد الحديد Fe2O3 فقد قلَّ ( 3+← 0)؛ أي أنها اختُزِلت،
بينما لم يتغيَّر عدد تأكسد الأكسجين ( 2-).
3 - أُحَدِّدُ العاملَ المؤكسد والعاملَ المُختزل:
لأنَّ ذرات الألمنيوم Al تأكسدت واختزَلت أيونات الحديد (+Fe3 ) في Fe2O3 ، فان Al يعد عامل مختزل،
أمّا أيوناتُ الحديد (+Fe3 ) فأكسدت ذرّات الألمنيوم وحدثت لها عمليَّة اختزال؛ لذلك يُعَدُّ أكسيدُ الحديد (Fe2O3) عاملً مؤكسدًا.
يلاحظ أنه رغم أنَّ أيونات الحديد (+Fe3 ) فقط هي التي اختُزِلت في التفاعل فإنَّ كامل المركَّب Fe2O3 يُعَدُّ عاملً مؤكسدًا،
وهو ما ينطبق على جميع تفاعلات التأكسد والاختزال؛
حيث يُعَدُّ المركَّبُ الذي تتأكسد إحدى ذرّاته عاملً مُختزلً، والمركَّبُ الذي تُختزل إحدى ذرّاته عاملً مؤكسدًا.
المثال 6 : أُحَدِّدُ العاملَ المؤكسد والعاملَ المُختزل في التفاعل الآتي:
PbO(s) + CO(g) → Pb(s) + CO2(g)
الحل:
أُحَدِّدُ أعداد التأكسد لجميع الذرّات في التفاعل:
+2 -2 +2 -2 0 +4 -2
PbO(s) + CO(g) → Pb(s) + CO2(g)
أُحَدِّدُ التغيُّرَ في أعداد التأكسد:
+2 +2 0 +4
PbO(s) + CO(g) → Pb(s) + CO2(g)
ألاحظ نقصانُ عدد تأكسد أيون الرصاص من ( 2+ في PbO ← صفر في Pb ) أي أنه اختُزل،
وزيادةُ عدد تأكسد ذرة الكربون من ( 2+ في CO الى 4+ في CO2) أي أنها تأكسدت،
أمّا عددُ تأكسد الأكسجين فلم يتغيَّر،
ومن ثَمَّ فإنَّ CO عاملٌ مُختزل لأنه اختزل الرصاص في PbO ، و PbO عاملٌ مؤكسد لأنه أكسد الكربون في CO.
أتحقَّق:
1- هل يحتاج حدوث التحوُّلات الآتية إلى عامل مؤكسد أم عامل مُختزل؟أُفَسِّرُ إجابتي.
أ) -I2 → 2I ب) +Sn2+ → Sn4 ج) Mn2+ → MnO2
أ. قل عدد التأكسد اليود من 0 الى 1-، نصف تفاعل اختزال / يحتاج عامل مختزل
ب. زاد عدد التأكسد Sn من 2+ الى 4+، نصف تفاعل تأكسد / يحتاج عامل مؤكسد
ج . زاد عدد التأكسد Mn من 2+ إلى 4+ ، نصف تفاعل تأكسد / يحتاج عامل مؤكسد
2 - أُحَدِّدُ العاملَ المؤكسد والعاملَ المُختزل في التفاعل الآتي:
H2(g) + CuO(s) → Cu(s) + H2O(l)
العاملَ المؤكسد CuO والعاملَ المُختزل H2
الربطُ مع الحياة:
تتعرَّضُ القطعُ الفضيّة للسواد معَ الزمن؛ بسبب تكوُّنِ مادَّة كبريتيد الفضّة على سطحها الخارجي. ويمكنُ إزالةُ هذه الطبقة بوَضع هذه القِطع الفضيّة
في ورق من الألمنيوم في وعاء يحتوي على محلول كربونات الصوديوم وملح الطعام، وتسخينه؛ فتتأكسد ذرات الألمنيوم وتَختَزِل أيونات الفضة حسب المعادلة:
فتستعيد القطع الفضية لمعانها وبريقها.
التأكسد والاختزال الذاتي Autoxidation-Reduction Reaction
ما المقصود بالتأكسد والاختزال الذاتي؟
تتضمَّنُ تفاعلات التأكسد والاختزال وجودَ عامل مؤكسد وعامل مُختزل، ولكن وُجد في بعض التفاعلات
أنَّ المادة نفسَها تسلك كعامل مؤكسد وكعامل مُختزل في التفاعل نفسه، ويسمّى تفاعل تأكسد واختزال ذاتي .
فمثلاً، يتحلَّلُ فوق أكسيد الهيدروجين H2O2 حسب المعادلة: 2H2O2(aq) → 2H2O(l) + O2(g)
أُحَدِّدُ أعدادَ التأكسد لجميع الذرّات في التفاعل كالآتي:
+1 -1 +1 -2 0 أعداد التأكسد
2H2O2(aq) → 2H2O(l) + O2(g)
ألاحظ عدم تغيُّر عدد تأكسد الهيدروجين، أمّا الأكسجين فقد اختُزل وقلَّ عدد تأكسده (من 1- في H2O2 إلى 2- في H2O )،
ومن ثَمَّ يكون H2O2 عاملً مؤكسدًا،
كما تأكسد الأكسجين وزاد عدد تأكسده (من 1- في H2O2 إلى 0 في O2 )، ومن ثَمَّ يكون H2O2 عاملً مُختزلً؛
ولأن التأكسد والاختزال حدثا لنفس العنصر وهو الأكسجين في H2O2 . فالتفاعلُ يمثِّلُ تأكسدًا واختزالً ذاتيًّا.
المثال 7
يتفاعل الكلور مع محلول هيدروكسيد الصوديوم البارد حسب المعادلة الكيميائيَّة الآتية:
2NaOH(aq) + Cl2(g) → NaCl(aq) + NaClO(aq) + H2O(l)
أُبَيِّنُ لماذا يُعَدُّ التفاعل أعلاه مثالً على تفاعلات التأكسد والاختزال الذاتي.
الحل: أحسب أعداد التأكسد لجميع الذرّات والأيونات في التفاعل كالآتي:
+1 -2 +1 0 +1 -1 +1 +1 -2 +1 -2 :أعداد التأكسد
2NaOH(aq) + Cl2(g) → NaCl(aq) + NaClO(aq) + H2O(l)
ألاحظ أنَّ أيون الصوديوم +Na أيونٌ متفرِّج لم يطرأ عليه تغيير؛ لذلك يُحذَفُ من المعادلة.
أُحَدِّدُ التغيُّرَ في أعداد التأكسد:
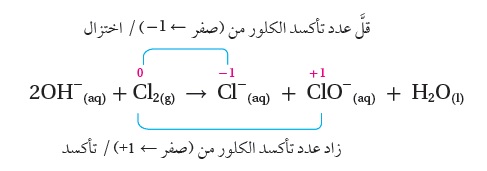
ألاحظ أنَّ أعداد التأكسد لجميع العناصر في المعادلة لم تتغيَّر باستثناء عدد التأكسد للكلور؛
إذ حدث تأكسد لذرّة كلور وزاد عدد تأكسدها (من صفر في Cl2 الى 1+ في -ClO )، وبذلك فإن Cl2 سلك كعامل مُختزل،
وكذلك حدث اختزالٌ لذرّة الكلور الثانية وقلَّ عدد تأكسدها (من صفر في Cl2 الى 1- في -Cl )، وبذلك فإنَّ Cl2 سلك كعامل مؤكسد؛
أي أنَّ التأكسد والاختزال حدثا لنفس العنصر في التفاعل. وعليه، فإنَّ التفاعل يمثِّلُ تفاعلَ تأكسد واختزال ذاتي.
اجابة سؤال أتحقَّق. أُحَدِّدُ المعادلات التي تمثِّلُ تفاعلَ تأكسد واختزال ذاتي:
أ- 2ClO3-(aq) → ClO4-(aq) + ClO2-(aq)
ب- + H2(g) + → H2SO4(aq) + Mg(s)
ج- 2CuCl(aq) → CuCl2(aq) + Cu(s)
الاجابة: المعادلة (أ) والمعادلة (ج)
موازنة معادلات التأكسد والاختزال Balancing Redox Equations
تحقق معادلة التأكسد والاختزال الموزونة قانون حفظ الكتلة؛
ممّا يعني أنَّ أنواع وأعداد ذرّات العناصر المكوِّنة للمواد المتفاعلة مماثلةٌ لها في المواد الناتجة.
وكذلك تحقق قانون حفظ الشحنة؛ أي أنَّ مجموع شحنات المواد المتفاعلة مساوٍ لمجموعها في المواد الناتجة،
ويتحقق ذلك عندما يكون عددُ الإلكترونات المكتسبة في أثناء تفاعل الاختزال مساويًا لعدد الإلكترونات المفقودة خلال تفاعل التأكسد.
فمثلً، في معادلة التفاعل الآتية:
Mg(s) + 2H+(aq) → Mg2+(aq) + H2(g)
يلاحظ أنَّ عدد ذرّات المغنيسيوم والهيدروجين متساوٍ على طرفي المعادلة،
وكذلك مجموع شحنات المواد المتفاعلة يساوي مجموعَها للمواد الناتجة، ويساوي (+ 2).
وعليه، يكون عدد الإلكترونات التي فقدتها ذرّة المغنيسيوم يساوي عدد الإلكترونات التي أكتسبها أيونا الهيدروجين، وتساوي ( ).
ولمّا كانت موازنة جميع معادلات التأكسد والاختزال بطريقة المحاولة والخطأ غير ممكنة،
فقد طوَّرَ العلماء طرائقَ أخرى لموازنتها، منها طريقة نصف التفاعل.
موازنة معادلات التأكسد والاختزال بطريقة نصف التفاعل
تعتمد طريقة نصف التفاعل Half-Reaction method لموازنة معادلة التأكسد والاختزال على:
- تجزئة المعادلة إلى نصفي تفاعل؛ نصف تفاعل تأكسد ونصف تفاعل اختزال،
- ثمَّ موازنة كل نصف تفاعل منفردًا من حيث أعدادُ الذرّات والشحنات،
- ثمَّ مساواة عدد الإلكترونات المفقودة والمكتسبة لنصفي التفاعل،
- يليها جمع نصفي التفاعل للحصول على المعادلة الموزونة،
والمثال الآتي يوضِّح ذلك:
المثال 8 : أوازن معادلة التأكسد والاختزال الآتية بطريقة نصف التفاعل:
Sn4+(aq) + Fe2+(aq) → Sn2+(aq) + Fe3+(aq)
خطوات الحل:
- أقسم معادلة التفاعل إلى نصفي تفاعل:
نصف تفاعل تأكسد (زاد عدد تأكسد Sn من 2+ ← 4+) +Sn2+ → Sn4
نصف تفاعل اختزال (قلَّ عدد تأكسد Fe من 3+ ← 2+) +Fe3+ → Fe2
- أوازن الذرّات في كل نصف تفاعل: +Sn2+ → Sn4
+Fe3+ → Fe2
ألاحظ أنَّ عدد الذرّات متساوٍ في طرفي المعادلة لكل نصف تفاعل.
- أوازن الشحنات:
ألاحظ في نصف تفاعل التأكسد أنه حتى يصبح مجموع الشحنات متساويًا على طرفي المعادلة يجب إضافة
إلى طرف المواد الناتجة: -Sn2+ → Sn4+ + 2e
أمّا في نصف تفاعل الاختزال فلا بدَّ من إضافة إلكترون واحد إلى طرف المواد المتفاعلة حتى يصبح مجموع الشحنات
على طرفي المعادلة متساويًا: +Fe3+ + e- → Fe2
- أُساوي عدد الإلكترونات المكتسبة والمفقودة:
ألاحظ أنَّ عدد الإلكترونات المفقودة في نصف تفاعل التأكسد يساوي ( )،
وأنَّ عدد الإلكترونات المكتسبة في نصف تفاعل الاختزال يساوي ( ).
ولمساواة عدد الإلكترونات المفقودة والمكتسبة يُضرَبُ نصفُ تفاعل الاختزال 2 ×
2 × ( +Fe3+ + e- → Fe2)
+2Fe3+ + 2e- → 2Fe2
- أجمع نصفي تفاعل التأكسد والاختزال: ( أحذف الالكترونات المتساوية من نصفي التفاعل)
+2Fe3+ + 2e- → 2Fe2
-Sn2+ → Sn4+ + 2e
+2Fe3+ + Sn2+ → Sn4+ + 2Fe2
ويمكن التحقق من صحِّة الموازنة بمقارنة أعداد الذرّات على طرفي المعادلة والتأكُّد من تساويها، والتأكُّد من أنَّ
المجموع الجبري للشحنات على طرفي المعادلة متساوٍ، معَ الإنتباه إلى عدم ظهور الإلكترونات في المعادلة النهائيَّة.
تحدث معظم تفاعلات التأكسد والاختزال في المحاليل المائيَّة في أوساط حمضيَّة أو قاعديَّة؛
لذلك فإنَّ خطوات موازنة معادلاتها تحتاج إلى خطوات إضافيَّة بحسب طبيعة الوسط، وهذا ما سيجري توضيحُهُ في الأمثلة اللاحقة.
موازنة معادلات التأكسد والاختزال بطريقة نصف التفاعل في وسط حمضي
عند حدوث تفاعل التأكسد والاختزال في وسط حمضي فإنَّ الماء وأيونات الهيدروجين يكونان جزءًا من التفاعل؛
لذلك يُستخدمان في موازنة معادلات تفاعلات التأكسد والاختزال، ولمعرفة كيفية إجراء ذلك، أدرس المثال الآتي:
المثال 9
وازن المعادلة الآتية بطريقة نصف التفاعل في الوسط الحمضي
Cr2O72-(aq) + HNO2(aq) → Cr3+(aq) + NO3-(aq)
الحل:
1 - أقسم معادلة التفاعل إلى نصفي تفاعل، وذلك بمقارنة المواد المتفاعلة والناتجة
Cr2O72-(aq) → Cr3+(aq)
HNO2(aq) → NO3-(aq)
2 - أختار أحدَ نصفي التفاعل وأوازنه باتباع الخطوات الآتية:
Cr2O72-(aq) → Cr3+(aq)
أ. أُوازنُ الذرّات، ما عدا الأكسجين O والهيدروجين H، بالضرب بمعامل مناسب بحيث تصبح أعداد الذرّات
متساوية على طرفي المعادلة:
ضُرِبَ ( 2 × +Cr3 )، فأصبح نصف التفاعل:
Cr2O72-(aq) → 2 Cr3+(aq)
ب. أُوازن ذرّات الأكسجين بإضافة عدد من جزيئات الماء H2O إلى طرف المعادلة الذي يحتوي على عدد أقل
من ذرّات الأكسجين بمقدار النقص فيها.
هنا، يُضافُ 7H2O إلى الطرف الأيمن من المعادلة فيصبح عدد ذرات الأكسجين ( 7) على طرفيها :
Cr2O72-(aq) → 2 Cr3+(aq) + 7H2O
ج. أُوازن ذرّات الهيدروجين بإضافة عدد من أيونات الهيدروجين +H إلى طرف المعادلة الذي يحتوي على عدد
أقل من ذرّات الهيدروجين بمقدار النقص فيها.
هنا، يُضافُ +14H إلى الطرف الأيسر من المعادلة فيصبح عدد ذرّات الهيدروجين ( 14 ) على طرفيها:
Cr2O72-(aq) + 14H+ → 2 Cr3+(aq) + 7H2O
د. أُوازن الشحنات بإضافة عدد من الإلكترونات (-e) إلى طرف المعادلة الذي يكون المجموع الجبري للشحنات فيه أكبر،
بحيث يصبح المجموع الجبري لها متساويًا على طرفيها.
Cr2O72-(aq) + 14H+ → 2 Cr3+(aq) + 7H2O
( -2 + +14) = +12 (+6 + 0 )= +6
ألاحظ أنَّ المجموع الجبري للشحنات على الطرف الأيسر للمعادلة يساوي ( +12 )، أمّا على طرفها الأيمن فيساوي ( +6 )؛
لذلك يُضافُ -6e إلى الطرف الأيسر، فيصبح المجموع الجبري للشحنات على طرفيها مساويًا ( +6):
Cr2O72-(aq) + 14H+ + 6e- → 2 Cr3+(aq) + 7H2O
+12 + (-6) = +6 +6
ألاحظ أنَّ الإلكترونات أُضيفت إلى جهة المواد المتفاعلة؛ أي أنها مكتسبة؛ لذا فإنَّ المعادلة تمثِّلُ نصف تفاعل الاختزال:
Cr2O72-(aq) + 14H+ + 6e- → 2 Cr3+(aq) + 7H2O
3 - لموازنة نصف التفاعل الآخر، أُطَبِّقُ الخطواتِ نفسَها في الخطوة ( 2):
-HNO2 → NO3
أ. أُوازن الذرّات، عدا الأكسجين والهيدروجين: يلاحظ أنَّ عدد ذرّات النيتروجين متساوٍ على طرفي المعادلة:
-HNO2 → NO3
ب. أُوازن ذرّات الأكسجين بإضافة جزيء ماء H2O إلى الطرف الأيسر من المعادلة:
HNO2 + H2O → NO3-
ج. أُوازن ذرّات الهيدروجين بإضافة ثلاثة أيونات هيدروجين +3H إلى الطرف الأيمن من المعادلة:
HNO2 + H2O → NO3- + 3H+
د. أُوازن الشحنات بإضافة إلكترونين (-2e ) إلى الطرف الأيمن، ليصبح المجموع الجبري للشحنات على طرفيها متساويًا:
HNO2 + H2O → NO3- + 3H+
( 0 + 0) = 0 (-1 + +3 )= +2
HNO2 + H2O → NO3- + 3H+ + 2e-
0 (+3 + -2) = 0
لاحظ أن الإلكترونات أضيفت إلى جهة المواد الناتجة؛ أي أنها مفقودة؛ لذا فإن المعادلة تمثل نصف تفاعل تأكسد.
وبذلك أصبح نصفا التفاعل متوازنين كل على حِدَة:
Cr2O72-(aq) + 14H+ + 6e- → 2 Cr3+(aq) + 7H2O
HNO2 + H2O → NO3- + 3H+ + 2e-
4 - يجب أن يتساوى عدد الإلكترونات المفقودة وعدد الإلكترونات المكتسبة خلال التفاعل الكلي؛ لذلك يلزم
أحيانًا ضربُ إحدى المعادلتين أو كليهما بمعاملات مناسبة بحيث يصبح عدد الإلكترونات المفقودة مساويًا لعدد
الإلكترونات المكتسبة في التفاعل.
لذلك، سَيُضرب نصفُ تفاعل التأكسد بالرَّقْمِ ( 3) ليصبح عدد الإلكترونات المفقودة ( ) مساويًا لعدد
الإلكترونات المكتسبة:
3 × (HNO2 + H2O → NO3- + 3H+ + 2e-)
3HNO2 + 3H2O → 3NO3- + 9H+ + 6e- نصف تفاعل التأكسد
Cr2O72-(aq) + 14H+ + 6e- → 2 Cr3+(aq) + 7H2O نصف تفاعل الاختزال
5- أجمع نصفي تفاعل التأكسد والاختزال للحصول على معادلة التفاعل الكُلِّيِّ الموزونة، وذلك بحذف الإلكترونات
من طرفي المعادلة، وأكتب المعادلة بأبسط صورة:
3HNO2 + 3H2O → 3NO3- + 9H+ + 6e- نصف تفاعل التأكسد
Cr2O72-(aq) + 14H+ + 6e- → 2 Cr3+(aq) + 7H2O نصف تفاعل الاختزال
______________________________________________________________
3HNO2 + Cr2O72-(aq)+ 5H+ → 3NO3- +2 Cr3+(aq) + 4H2O المعادلة الكليَّة
اجابة سؤال أتحقَّقُ:
أُوازن المعادلتين الآتيتين بطريقة نصف التفاعل في الوسط الحِمضي، وَأُحَدِّد العاملَ المؤكسد والعاملَ المُختزل في كلٍّ منها.
Br-(aq) + CO2(g) → 1- BrO3-(aq) + C2O42-(aq)
2CO2(g) + 2e- ) x 3 → ( C2O42-(aq)
6CO2(g) + 6e- → 3C2O42-(aq)
Br-(aq) + 3H2O → BrO3-(aq) + 6H+ + 6e-
المعادلة الكلية Br-(aq) + 3H2O + 6CO2(g) → BrO3-(aq) + 6H+ 3C2O42-(aq) +
العامل المؤكسد BrO3- العامل المختزل C2O42-
2- As(s) + ClO3-(aq) → H3AsO3(aq) + HClO(aq)
( As(s) + 3H2O → H3AsO3(aq) + 3H+ + 3e-) x4
( 4e- + 5H+ + ClO3- → + HClO + 2H2O ) x 3
4As(s) + 12H2O → 4H3AsO3(aq) + 12H+ + 12e-
12e- + 15H+ + 3ClO3- → + 3HClO + 6H2O
4As(s) + 6H2O + 3ClO3- + 3H+ → 4H3AsO3(aq) + 3HClO المعادلة الكلية
العامل المؤكسد -ClO3 العامل المختزل As
موازنة معادلات التأكسد والاختزال بطريقة نصف التفاعل في وسط قاعدي:
توازَنُ معادلات التأكسد والاختزال في وسط قاعدي بالخطوات نفسِها المتَّبعة لموازنتها في الوسط الحمضي،
ثمَّ يضاف عددٌ من أيونات الهيدروكسيد -OH مساوٍ لعدد أيونات الهيدروجين +H في المعادلة الموزونة في الوسط الحمضي إلى طرفي المعادلة؛
حيث تتعادل أيوناتُ الهيدروجين +H مع أيونات الهيدروكسيد -OH مكوِّنةً عددًا من جزيئات الماء H2O ،
ثمَّ تُختَصَرُ جزيئاتُ الماء في طرفي المعادلة أو تٌجمع إذا كانت في الطرف نفسه بحيث تظهر في أحد أطراف التفاعلَ الكُلِّيَّ الموزون؛
وبذلك نحصل على معادلة موزونة في الوسط القاعدي.
مثال 10
أُوازن المعادلة الآتية بطريقة نصف التفاعل في الوسط القاعدي
MnO4-(aq) + ClO2-(aq) → MnO2(s) + ClO4-(aq)
الحل:
تُطَبَّقُ خطواتُ موازنة المعادلة في الوسط الحِمضي نفسُها أولًا:
1- أقسمُ معادلة التفاعل إلى نصفي تفاعل، وذلك بمقارنة المواد المتفاعلة والناتجة:
MnO4- → MnO2
ClO2-(aq) → ClO4-(aq)
2-أختارُ أحد نصفي التفاعل، وأُوازنه باتباع الخطوات الآتية:
MnO4- → MnO2
:Mn أ- موازنة الذرّات عدا الأكسجين والهيدروجين: يلاحظ أنَّ عدد ذرات المنغنيز متساوٍ على طرفي المعادلة
MnO4- → MnO2
ب- أُوازن ذرّات الأكسجين بإضافة جزيئي ماء 2H2O إلى طرف المعادلة الأيمن:
2H2O + MnO4- → MnO2
ج- أُوازن ذرّات الهيدروجين بإضافة أربعة أيونات هيدروجين +4H إلى طرف المعادلة الأيسر، فيصبح عدد ذرّات H متساويًا على طرفيها:
MnO4- + 4H+ → MnO2 + 2H2O
د- أُوازن الشحنات بإضافة ثلاثة الإلكترونات (-3e ) إلى طرف المعادلة الأيسر،
فيصبح المجموع الجبري للشحنات على طرفيها متساويًا:
نصف تفاعل اختزال: MnO4- + 4H+ + 3e- → MnO2 + 2H2O
أُطَبِّقُ الخطوات الواردة في الخطوة ( 2) نفسِها لموازنة نصف التفاعل الآخر:
أ. أُوازن الذرّات، عدا الأكسجين والهيدروجين: يلاحظ أنَّ عدد ذرّات الكلور Cl متساوٍ على طرفي المعادلة:
ClO2- → ClO4-
ب. أُوازن ذرّات الأكسجين بإضافة جزيئي ماء 2H2O إلى طرف المعادلة الأيسر:
ClO2- + 2H2O → ClO4-
ج- أُوازن ذرّات الهيدروجين بإضافة أربعة أيونات هيدروجين +4H إلى طرف المعادلة الأيمن، فيصبح عدد ذرّات H متساويًا على طرفيها:
ClO2- + 2H2O → ClO4- + 4H+
د- أُوازن الشحنات بإضافة أربعة إلكترونات (-4e ) إلى طرف المعادلة الأيمن، فيصبح المجموع الجبري للشحنات على طرفيها متساويًا:
ClO2- + 2H2O → ClO4- + 4H+ + 4e- نصف تفاعل تأكسد
3- أُساوي عدد الإلكترونات المفقودة والمكتسبة، بضرب نصف تفاعل التأكسد 3 × ، ونصف تفاعل الاختزال 4 × .
(ClO2- + 2H2O → ClO4- + 4H+ + 4e- )x3 نصف تفاعل تأكسد
نصف تفاعل اختزال 4X(MnO4- + 4H+ + 3e- → MnO2 + 2H2O)
4- للحصول على معادلة التفاعل الكُلِّيِّ الموزونة في وسط حِمضي، أجمعُ نصفي تفاعل التأكسد والاختزال:
3ClO2- + 6H2O → 3ClO4- + 12H+ + 12e-
4MnO4- + 16H+ + 12e- → 4MnO2 + 8H2O
______________________________________________________________________________
3ClO4- + 4MnO2 + 2H2O → 3ClO2- + 4MnO4- + 4H+
5- أُضيف إلى طرفي المعادلة عددًا من أيونات OH- مساويًا لعدد أيونات H+:
2H2O + 4OH- 3ClO4- + 4MnO2 + → + 4OH- 3ClO2- + 4MnO4- + 4H+
6- أجمعُ أيونات H+ وأيونات OH-الموجودة في الطرف نفسِه من المعادلة معًا على شكل جُزيئات ماء.
2H2O + 4OH- 3ClO4- + 4MnO2 + → + 4OH- 3ClO2- + 4MnO4- + 4H+
4H2O
7- أختصِرُ جُزيئات الماء بحيث تظهرُ في أحد طرفي معادلة التفاعل الكُلِّيِّ الموزونة في وسط قاعدي.
2H2O + 4OH- 3ClO4- + 4MnO2 + → 4H2O3ClO2- + 4MnO4- +
المعادلة الكلية: + 4OH- 3ClO4- + 4MnO2 → 2H2O3ClO2- + 4MnO4- +
مثال 11
أُوازن المعادلة الآتية بطريقة نصف التفاعل في الوسط القاعدي
Br2(l) → Br-(aq) + BrO3-(aq)
الحل:
1-أقسمُ معادلة التفاعل إلى نصفي تفاعل، وذلك بمقارنة المواد المتفاعلة والناتجة.
يلاحظ وجود مادَّة متفاعلة واحدة فقط في المعادلة، هي Br2؛ لذلك أستخدمُها في كلٍّ من نصف تفاعل التأكسد ونصف تفاعل الاختزال.
Br2 → Br-
Br2 → BrO3-
2- أختارُ أحد نصفي التفاعل، وأُوازنه باتباع الخطوات الآتية:
Br2 → Br-
أ. أُوازن ذرّات البروم بضرب أيون البروم Br- ×2، فيصبح نصف التفاعل موزونًا من حيث الذرّات:
-Br2 → 2Br
ب. أُوازن الشحنات بإضافة إلكترونين (2e-) إلى طرف المعادلة الأيسر:
نصف تفاعل اختزال: -Br2 + 2e- → 2Br
أُطَبِّقُ الخطواتِ نفسِها التي اتَّبعتُها لموازنة الذرّات والشحنات في موازنة نصف التفاعل الآخر:
Br2 → BrO3-
أ. موازنة الذرّات، عدا الأكسجين والهيدروجين:
Br2 → 2BrO3-
ب. موازنة ذرّات الأكسجين والهيدروجين:
Br2 + 6H2O → 2BrO3- + 12H+
ج. موازنة الشحنات:
Br2 + 6H2O → 2BrO3- + 12H+ + 10e-
3- أُساوي عدد الإلكترونات المفقودة والمكتسبة بضرب (نصف تفاعل الاختزال ×5)،
فيصبح عدد الإلكترونات المكتسبة مساويًا لعدد الإلكترونات المفقودة، وتساوي (10e).
( -Br2 + 2e- → 2Br )5 x
نصف تفاعل اختزال -5Br2 + 10e- → 10Br
نصف تفاعل التأكسد -Br2 + 6H2O → 2BrO3- + 12H+ + 10e
4- للحصول على المعادلة الموزونة في وسط حِمضي، أجمعُ نصفي تفاعل التأكسد والاختزال: -5Br2 + 10e- → 10Br
-Br2 + 6H2O → 2BrO3- + 12H+ + 10e
________________________________________________________________________________________ 6Br2 + 6H2O → 2BrO3- +10Br- + 12H+
5- أُضيفُ 12OH- إلى طرفي المعادلة:
6Br2 + 6H2O + 12 OH- → 2BrO3- +10Br- + 12H+ + 12OH-
12H2O
6- أجمعُ أيونات H+ وأيونات OH- في الطرف نفسه من المعادلة معًا على شكل جُزيئات ماء.
6Br2 + 12 OH- → 2BrO3- +10Br- + 6H2O المعادلة الكليَّة:
ألاحظ أنَّ المعادلة ليست في أبسط صورة؛ لذلك أقسمُها على 2 وأكتبُها بأبسط صورة.
3Br2 + 6OH- → BrO3- + 5Br- + 3H2O
مثال 12
أُوازن نصف التفاعل الآتي بطريقة نصف التفاعل في الوسط القاعدي:
NO3-(aq) → NH3(aq)
الحل:
1- أُوازن الذرّات:
NO3-(aq) → NH3(aq)
ألاحظ أنَّ عدد ذرّات النيتروجين متساوٍ على طرفي المعادلة،
فأُوازن ذرّات الأكسجين بإضافة 3H2O إلى طرف المعادلة الأيمن،
ثمَّ أُوازن ذرّات الهيدروجين بإضافة 9H+ إلى طرف المعادلة الأيسر:
NO3- + 9H+ → NH3 + 3H2O
2- أُوازن الشحنات بإضافة 8e- إلى طرف المعادلة الأيسر:
NO3- + 9H+ + 8e- → NH3 + 3H2O
3- أصبح التفاعل موزونًا في وسط حِمضي، فأضيف 9 OH- إلى طرفي المعادلة:
NO3- + 9H+ + 9 OH- + 8e- → NH3 + 3H2O + 9 OH-
4- أجمعُ أيونات H+ وأيونات OH- في الطرف نفسه من المعادلة معًا على شكل جُزيئات ماء.
NO3- + 9H+ + 9 OH- + 8e- → NH3 + 3H2O + 9 OH-
9H2O
5- أختصِرُ جُزيئات الماء بحيث تظهر في أحد طرفي معادلة نصف التفاعل الموزونة في وسط قاعدي
NO3- + 6H2O + 8e- → NH3 + + 9 OH-
اجابة سؤال أتحقَّقُ:
أُوازن المعادلتين الآتيتين بطريقة نصف التفاعل في الوسط القاعدي، وَأُحَدِّد العاملَ المؤكسد والعاملَ المُختزل في كلٍّ منها.
1- CN-(aq) + AsO33-(aq) → AsO22-(aq) + CNO-(aq)
( CN- + H2O → CNO- + 2H+ + 2e- )
( AsO33- + 2H+ + 1e- → AsO22- + H2O ) x2
CN- + H2O → CNO- + 2H+ + 2e-
2AsO33- + 4H+ + 2e- → 2AsO22- + 2H2O
CN- + 2AsO33- + 2H+ + 2OH- → CNO- + 2AsO22- + H2O + 2OH-
CN- + 2AsO33- +H2O → CNO- + 2AsO22- + + 2OH- المعادلة الكلية
العامل المؤكسد العامل المختزل -CN
2- NiO2(s) + S2O32-(aq) → Ni(OH)2(aq) + SO32-(aq)
( NiO2 + 2H+ + 2e- → Ni(OH)2 ) x2
S2O32- + 3H2O → 2SO32- + 6H+ + 4e-
2NiO2 + 4H+ + 4e- → 2Ni(OH)2
S2O32- + 2NiO2 + 3H2O + 2 OH- → 2SO32- + 2Ni(OH)2 + 2H+ + 2 OH-
S2O32- + 2NiO2 + H2O + 2 OH- → 2SO32- + 2Ni(OH)2
العامل المؤكسد NiO2 العامل المختزل -S2O32