تجربة استهلالية: خصائص الحموض والقواعد
المواد والأدوات: محلول حمض الهيدروكلوريك HCl تركيزه 0.1M ، محلول هيدروكسيد الصوديوم NaOH تركيزه 0.1M ،أنابيب اختبار عدد 3 ، حامل أنابيب، أوراق الكاشف العام، محبار مدرج، ميزان حرارة ، كأس زجاجية، ماء مقطر.
إرشادات السلامة:: أتبع ارشادات السلامة العامة في المختبر- أرتدي معطف المختبر والنظارات الواقية والقفارات- أحذر استنشاق حمض الهيدروكلوريك ولمس محلول هيدروكسيد الصوديوم.
خطوات العمل:
1- أفيس: استخدم المخبار المدرج في قياس 3mL من محلول حمض الهيدروكلوريك ثم أضعها في أنبوب اختبار وأرقمه 1
2-أقيس درجة حرارة المحلول باستخدام ميزان الحرارة ،وأسجلها.
3-أىحظ: أغمس ورقة الكاشف العام في المحلول والاحظ تغير لونها وأسجله.
4-أقيس: أستخدم المخبار المدرج في قياس3mL من محلول هيدروكسيد الصوديوم ثم أضعها في أنبوب اختبار آخر وأرقمه 2
5- أكرر الخطوتين 2و3 لمحلول هيدروكسيد الصوديوم وأسجل النتائج.
6- أجرب: أسكب محتويات الأنبوب 1 في كاس زجاجية وأضيف اليها تدريجيا محلول هيدروكسيد الصوديوم من الأنبوب 2، ثم أكرر الحطوتين 2و3 لمحتويات الكأس الزجاجية وأسجل النتائج.
التحليل والاستنتاج:
1-يتحول لون ورقة الكاشف العام إلى اللون الأحمر في محلول حمض الهيدروكلوريك، وإلى اللونا لازرق في محلول هيدروكسيد الصوديوم.
2- يجب أن تكون أقل من 7 بالنسبة لمحلول الحمض، وأكبر من 7 لمحلول القاعدة.
3- ارتفاع في درجة حرارة المحلول الناتج عن خلط محلول الحمض مع محلول القاعدة، وتفسير ذلك حدوث تفاعل تعادل بين محلول الحمض والقاعدة، وهو تفاعل طارد للحرارة ما سبّب ارتفاع درجة حرارة المحلول الناتج.
4- يكون الرقم الهيدروجين للمحلول الناتج يساوي .7
الدرس 1
مفاهيمُ الحموض والقواعد Acid Base Concepts
توجد الحموضُ والقواعد في كثير منَ المواد الغذائيّة، فالحموض تعطي الأطعمة طعمًا حامضًا أو لاذعًا، فالليمون والبرتقال والبندورة تحتوي على حموض، مثل حمض السيتريك، الذي يكسبُها الطعم الحِمضي،كما تحتوي المشروبات الغازيّة على حِمض الكربونيك،
وتؤثر الحموضُ في الكواشف المختلفة،فهي تحوِّلُ لونَ ورقة تبّاع الشمس الزرقاء إلى اللون الأحمر.
أمّا القواعدُ فتوجد في كثير منَ الموادّ الغذائيّة، مثل الخضراوات، كالسبانخ والبروكلي والخيار، وبعض الفواكه، مثل التفاح والمشمش والفراولة، وتدخلُ القواعد في صناعة المنظفات، فمثلًا يُستعمل هيدروكسيد الصوديوم في صناعة المنظفات المنزليّة، وصناعة الصابون،
وتتميَّزُ القواعد بطعمها المُرِّ وملمسها الزَّلِق وتأثيرها في الكواشف، فهي تحوِّلُ لونَ ورقة تبّاع الشمس الحمراء إلى اللون الأزرق.
وقد تطور مفهوما الحمض والقاعدة عبر سلسلة من الدراسات والأبحاث ليشمل أكبر عدد من المواد ، وفيما يلي أهم مفاهيم الحموض والقواعد:
مفهومُ أرهينيوس Arrhenius Concept
تمكَّنَ العالِمُ أرهينيوس،عن طريق دراسته التوصيل الكهربائيّ لمحاليل الموادّ الأيونيّة، من وضع تصوُّر حول مفهوم كلٍّ منَ الحِمض والقاعدة، وقد عُدَّ هذا خطوةً رائدة في مجال الكيمياء والتحليل الكيميائي.
فما المقصودُ بالحِمض عند أرهينيوس؟ وما المقصودُ بالقاعدة؟
حِمض أرهينيوس :
عرفً أرهينيوس الحمض Acid أنه: مادّةٌ تتأيَّنُ في الماء وتنتج أيونَ الهيدروجين (+H).
فمثلاً، عند إذابة غاز كلوريد الهيدروجين HCl في الماء ينتج أيونُ الهيدروجين+H في المحلول، كما في المعادلة الآتية:
وكذلك حِمض النيتريك HNO3، فيتأيَّنُ في الماء مُنتِجًا أيونَ الهيدروجين +H،
كما في المعادلة الآتية:
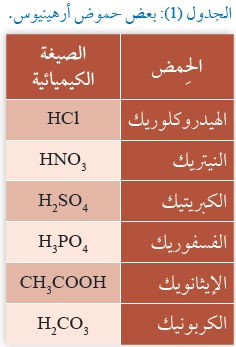
وهذا ينطبقُ على جميع حموض أرهينيوس؛ فهي تحتوي على ذرّة هيدروجين أو أكثر، قابلة للتأيُّن ، ويبيِّنُ الجدول (1) بعضَ حموض أرهينيوس.فبعض الحموض تحتوي على ذرّة هيدروجين واحدة، مثل HCl، ويسمّى حِمضا أُحادِيَّ البروتون Monoprotic Acid، وبعضها يحتوي على ذرّتي هيدروجين، مثل حِمض الكبريتيك H2SO4، ويسمّى حِمضا ثنائِيَّ البروتون Diprotic Acid، في حين يحتوي بعضُها على ثلاث ذرّات هيدروجين، مثل حِمض الفسفوريك H3PO4، ويسمّى حِمضا ثلاثِيَّ البروتون Triprotic Acid
أفسر: يعد حِمض الإيثانويك CH3COOH أحادي البروتون رغم احتوائه على أربع ذرات كربون.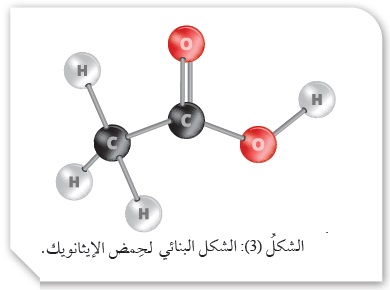
بالتدقيق في صيغة حِمض الإيثانويك CH3COOH نجد أنه يحتوي على ثلاث ذرّات هيدروجين مرتبطة بذرّة الكربون ليس لها القدرة على التأيُّن؛لأنَّ الروابط بينها غيرُ قطبيّة ممّا يمنع تأيُّنَها، كما يظهر في الشكل (3) ، وهناك ذرّة هيدروجين أخرى مرتبطة بذرة الأكسجين ذات السالبيّة الكهربائيّة العالية، وهي الوحيدة التي تتأيَّنُ في المحلول؛ ولذلك يُصَنَّفُ على أنه حِمض أُحادي البروتون، كما في المعادلة الآتية:
CH3COOH (aq) H+(aq) + CH3COO-(aq)
قاعدةُ أرهينيوس Arrhenius Base
فمثلًا، عند إذابة هيدروكسيد الصوديوم NaOH في الماء ينتج أيونُ الهيدروكسيد -OH،
كما في المعادلة الآتية:
NaOH (s) OH-(aq) + Na+(aq)
ويتأين هيدروكسيد البوتاسيوم KOH في الماء، كما في المعادلة
الآتية:
KOH (s) OH-(aq) + K+(aq)
وينطبق ذلك -بشكل عام- على هيدروكسيدات فلزّات المجموعتين
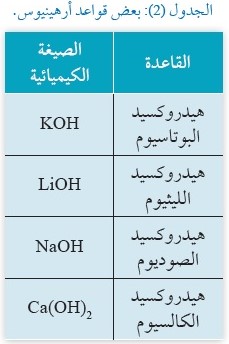
الأولى والثانية من الجدول الدوري، ويبيِّنُ الجدولُ (2) بعضَ قواعد أرهينيوس.
يتضح منَ الجدول أنَّ قواعد أرهينيوس كُلِّها تحتوي على أيون الهيدروكسيد، فبعضها يحتوي على أيون هيدروكسيد واحد، مثل هيدروكسيد الصوديوم NaOH، وبعضها يحتوي على أيوني هيدروكسيد، مثل هيدروكسيد الكالسيوم Ca(OH)2 .
وسنقتصر في دراستنا على الحموض أحادية البروتون والقواعد أحادية الهيدروكسيد.
لماذا يعد مفهوم أرهينيوس محدوداً ( جوانب القصور في مفهوم ارهينيوس)؟
رغم الإنجاز الكبير الذي حققه مفهومُ أرهينيوس في مجال الكيمياء، فقد بقي محدودًا بسبب:
تناوله الحموض والقواعد في المحاليل المائيّة فقط، ولم يتمكَّن من تفسير التأثير القاعدي لقواعد معروفة لا تحتوي على (OH)، مثل الأمونيا NH3،
ولم يتمكن من تفسير التأثير الحِمضي أو القاعدي للأملاح، مثل كلوريد الأمونيوم NH4Cl الحمضي، أو كربونات الصوديوم الهيدروجينيةNaHCO3 القاعدية.
اجابة سؤال أتحقق:
1) أُصَنِّفُ الموادَّ الآتية إلى حموضٍ وقواعدَ وفقَ مفهوم أرهينيوس: HClO4, KOH, HNO3, HCOOH, Sr(OH)2
الجواب: حموض أرهينيوس: HClO4 , HNO3 , HCOOH
قواعدَ أرهينيوس: KOH , Ba(OH)2
2) أكتبُ معادلة تبيِّنُ التأثيرَ القاعدي لمحلول هيدروكسيد الليثيوم LiOH.
لتفسير التأثيرَ القاعدي لمحلول هيدروكسيد الليثيوم LiOH أكتب معادلة تأين القاعدة في الماء حيث يكتب الماء على السهم كما يلي:
أيونُ الهيدرونيوم Hydronium Ion
يتأيَّنُ الحِمض في المحلول وينتج أيونَ الهيدروجين+H ،الذي يتكوَّنُ منَ بروتون واحد فقط، وهو جسيم صغير جدًّا يحمل شحنة كهربائيّة عالية جدًّا(ذو كثافة كهربائية عالية) ، فلا يمكن أن يوجد منفردًا في المحلول؛ إذ يرتبط أيونُ الهيدروجين بجزيء ماء مكوِّنًا أيونَ الهيدرونيوم
كما في المعادلة الآتية:
H+(aq) + H2O(l) H3O+(aq)
وبهذا يمكن التعبيرُ عن أيون الهيدروجين في المحلول باستخدام أيون الهيدرونيومH3O+، وبذلك تكتبُ معادلةُ تأيُّن كلوريد الهيدروجين HCl كما يلي:
HCl(g) + H2O(l) H3O+ (aq) + Cl-(aq)
مفهومُ برونستد – لوري Bronsted–Lowry Concept
قَدَّمَ مفهومُ أرهينيوس تفسيرًا مقبولاً لسلوك كثير منَ الحموض والقواعد، إلا أنه لم يتمكَّن من تفسير كثير من تفاعلاتها، مثل تفاعل حِمض الهيدروكلوريك HCl معَ الأمونيا NH3، الذي ينتج ملح كلوريد الأمونيوم NH4Cl، الذي يمثِّلُ تفاعلَ حِمض معَ قاعدة، سواء في المحاليل أو في الحالة الغازيّة، كما يأتي:
فالأمونيا NH3 قاعدة لا تحتوي على أيون الهيدروكسيد؛ ممّا دفع الكيميائيين إلى تطوير مفهومي الحِمض والقاعدة؛إذ تمكَّنَ العالمان برونستد، ولوري من وضع تصوُّر جديد لمفهوم الحِمض والقاعدة بالاعتماد على انتقال البروتون+H (أيون الهيدروجين)منَ الحِمض إلى القاعدة في أثناء التفاعل؛ وبذلك فقد قدَّما تعريفًا أكثرَ شمولا لكلٍّ منَ الحِمض والقاعدة.
فكيف عرّفا برونستد-لوري الحمض والقاعدة؟
حِمض برونستد-لوري: مادّةٌ يمكنها منحُ بروتون واحد في أثناء التفاعل (مانح للبروتون)،
قاعدة برونستد- لوري: مادّةٌ يمكنها استقبالُ بروتون واحد في أثناء التفاعل (مستقبل للبروتون).
فمثلا، عند إذابة كلوريد الهيدروجين HCl في الماء فإنه يمنح البروتونَ (+H)، ويمثِّلُ الحِمض، بينما يستقبل الماء البروتونَ (+H)، ويمثِّلُ القاعدة، والمعادلة الآتية توضِّحُ ذلك:
HCl(g) + H2O(l) H3O+ (aq) + Cl-(aq)
مستقبل مانح
أمّا عند إذابة الأمونياNH3 في الماء فإنها تستقبلُ البروتونَ (+H) منَ الماء؛ وبهذا فإنها تمثِّلُ القاعدة، في حين يمثِّلُ الماءُ الحِمض في التفاعل، كما في المعادلة الآتية:
NH3(aq) + H2O(l) NH4+(aq) + OH-(aq)
مانح مستقبل
وعند خلط محلول HCl معَ محلول NH3 ينتقل البروتونُ (+H) من HCl، الذي يمثِّلُ الحِمض في التفاعل، إلى NH3، التي تمثِّلُ القاعدة، والمعادلة الآتية توضِّحُ ذلك:
NH3(aq) + HCl(aq) NH4+(aq) + Cl-(aq)
مانح مستقبل
وبهذا يمكن النظرُ إلى التفاعلات التي يحدث فيها انتقالٌ للبروتون على أنها تفاعلاتُ حِمض وقاعدة.
الأزواجُ المترافقة Conjucated Pairs
فَسَّرَ برونستد- لوري كثيرًا من تفاعلات الحموض والقواعد بالاعتماد على انتقال البروتون منَ الحِمض إلى القاعدة في التفاعل. فمثلًا، يتفاعل الحِمض HCl معَ محلول القاعدة CH3NH2، كما في المعادلة الآتية:
HCl(g) + CH3NH2(aq) CH3NH3+(aq) + Cl-(aq)
يَتَّضِحُ منَ المعادلة أنَّ الحِمض HCl يمنحُ البروتونَ +H، ويُنتِجُ الأيونَ -Cl، الذي يسمّى قاعدة مرافقة ، وهي المادّةُ الناتجة عن منح الحِمض للبروتون،
كما تستقبلُ القاعدةُ CH3NH2 البروتونَ +H، وينتج عن ذلك الأيونُ +CH3NH3، ويسمّى الحِمض المرافق ، وهي المادّةُ الناتجة عن استقبال القاعدة للبروتون؛
وبهذا يكون لكلِّ حِمض في التفاعل قاعدةٌ مرافقة في الموادّ الناتجة، ولكلِّ قاعدة في التفاعل حِمض مرافق في الموادّ الناتجة،
وَيُسَمّى الحِمض وقاعدتُهُ المرافقة، أو القاعدةُ وحِمضها المرافق، زوجًا مترافقًا.
ويمكن ملاحظةُ ذلك أيضًا عند تفاعل حِمض الهيدروفلوريك معَ الماء، كما في المعادلة الآتية:
HF(g) + H2O(l) F-(aq) + H3O+ (aq)
حِمض مرافق قاعدة مرافقة القاعدةُ الحِمض
يَتَّضِحُ أنَّ التفاعل يشتمل على زوجين مترافقين، هما:
الحِمض وقاعدته المرافقة (-HF/F) ، والقاعدة وحِمضها المرافق ( +H2O/H3O).
ويشتملُ تفاعلُ الأمونيا NH3 معَ الماء على زوجين مترافقين أيضًا، كما يَتَّضِحُ في المعادلة الآتية: NH3(aq) + H2O(l) NH4+(aq) + OH-(aq)
قاعدة مرافقة حِمض مرافق الحِمض القاعدةُ
يَتَّضِحُ أنَّ التفاعل يشتمل على زوجين مترافقين، هما:
القاعدة وحِمضها المرافق(+NH3/NH4)،والحِمض وقاعدته المرافقة (-H2O/OH) .
وبهذا فإنَّ التفاعل وفقَ مفهوم برونستد لوري يحتوي على زوجين مترافقين: الحِمض وقاعدته المرافقة، والقاعدة وحِمضها المرافق.
ويشتمل تفاعل حمض H2CO3 مع القاعدة على زوجين مترافقين كما يتضح من المعادلة:
ألاحظ أن الحمض H2CO3 منح بروتونا واحدا للقاعدة فيكون زوجا مترافقا من الحمض وقاعدته المرافقة، و زوجا مترافقا من القاعدة وحمضها المرافق.
اجابة سؤال أتحقق:
أُحَدِّدُ الزوجين المترافقين في كلٍّ منَ التفاعلين الآتيين:
الحمض وقاعدته المرافقة : -H2SO3 / HSO3 ، والقاعدة وحمضها المرافق : CN- / HCN
الحمض وقاعدته المرافقة : -H2O / OH والقاعدة وحمضها المرافق : +CH3NH2 / CH3NH3
قوَّةُ الحِمض والقاعدة: Acid and Base Strength
ترتبط قوَّةُ الحِمض بقدرته على التأيُّن ومنح البروتون، فالحِمض القويُّ يتأيَّنُ كُليًّا في المحلول، ويتجه التفاعل نحو تكوين الموادّ الناتجة.
فمثلًا، يتأيَّنُ الحِمض HCl في الماء كُليًّا، كما في المعادلة الآتية:
HCl(aq) + H2O H3O+(aq) + Cl-(aq)
قاعدة مرافقة حِمض مرافق قاعدة حِمض
يَتَّضِحُ منَ المعادلة أنَّ HCl في المحلول يسلُكُ سلوكَ الحِمض، بينما يسلُكُ الماءُ H2O سلوكَ القاعدة، فإذا افترضنا حدوثَ تفاعل عكسي فإنَّ الأيون-Cl يسلُكُ كقاعدة، بينما يسلُكُ +H3O سلوكَ الحِمض. وبما أنَّ التفاعلَ يتَّجِه كُليًّا نحوَ تكوين الموادّ الناتجة، فإنَّ ذلك يشيرُ إلى أنَّ الحِمض HCl أكثرُ قدرةً على منح البروتون منَ الحِمض+H3O، وأنه أقوى منَ الحِمض+H3O، كما يشيرُ إلى أنَّ القاعدة -Cl أقلُّ قدرةً على استقبال البروتون منَ القاعدةH2O ، ويكون الماء أقوى كقاعدة من -Clوبهذا نجد أنَّ الحِمض والقاعدة في جهة الموادّ المتفاعلة أقوى منَ الحِمض والقاعدة في جهة الموادّ الناتجة،وأنَّ التفاعل يتَّجِه نحوَ تكوين الموادّ الناتجة بنسبة عالية
( الأضعف في التفاعل)
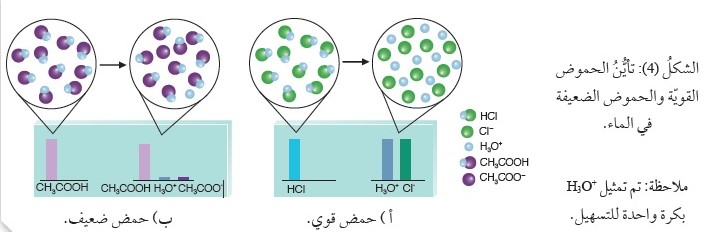
لاحظ الشكل المجاور الذي يبين نسبة تراكيز المواد الناتجة ما يشيرُ إلى عدم حدوث تفاعل عكسي؛ ولذلك يُعَبَّرُ عنِ التفاعل بسهم باتجاه واحد، كما في المعادلة:
HCl(aq) + H2O(aq) H3O+(aq) + Cl-(aq)
أمّا الحموض الضعيفة فتتأيَّنُ جُزئيًّا في المحلول، ويكون التفاعل منعكسًا. فمثلا، يتأيَّنُ
حِمض الإيثانويك CH3COOH في الماء بدرجة ضئيلة، كما في المعادلة الآتية:
CH3COOH(aq) + H2O H3O+(aq) + CH3COO-(aq)
قاعدة مرافقة حِمض مرافق قاعدة حِمض
تشيرُ درجةُ التأيُّن الضئيلة للحِمض CH3COOH إلى أنَّ تركيزَهُ في المحلول يكون عاليًا مقارنةً بتركيز الحِمض+H3O، ويبين الشكل المجاور نسبة تراكيز المواد الناتجة والمتفاعلة، ما يعني أنَّ الحِمض CH3COOH أقلُّ قدرةً على منح البروتون منَ الحِمض+H3O ؛ وبهذا يكون الحِمض CH3COOH أضعفَ منَ الحِمض+H3O، كما نجد أنَّ القاعدة -CH3COO أكثرُ قدرةً على استقبال البروتون منَ القاعدة H2O في المحلول؛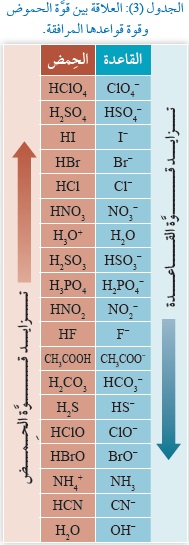 وبهذا تكون القاعدةُ -CH3COO أقوى
وبهذا تكون القاعدةُ -CH3COO أقوى
منَ القاعدة H2O، وهذا يُفَسِّرُ حدوثَ التفاعل العكسي.
يَتَّضِحُ ممّا سبق أنَّ الحِمض القوي HCl تكون قاعدتُهُ المرافقة -Cl
ضعيفة نسبيًّا، وأنَّ الحِمض الضعيف CH3COOH تكون قاعدتُهُ المرافقة -CH3COO قويّة نسبيًّا، وكلّما زادت قوَّةُ الحِمض قلّت قوَّةُ القاعدة
المرافقة الناتجة عنه،
وأنَّ التفاعل يتَّجِه نحو تكوين الموادّ الأضعف؛ أي أنَّ موضع الاتزان يُزاح
جهة الموادّ الأضعف في التفاعل،
ويبيِّنُ الجدول المجاور العلاقة بين قوَّة الحموض وقوَّة قواعدها المرافقة. وينطبق ذلك على القواعد الضعيفة وحموضها المرافقة، فالقاعدة الأقوى يكون حِمضها المرافق أضعف، وكلّما زادت قوَّةُ القاعدة قلّت قوَّةُ الحِمض المرافق الناتج عنها.
إجابة سؤال أتحقق:
اعتمادًا على الجدول المجاور، أُجيب عنِ الأسئلة الآتية:
1) أُحَدِّدُ الحِمض الأقوى بين الحموض الآتية: HNO2 ,HBr, H2CO3
الحمض الأقوى HBr 2) أُحَدِّدُ أيَّ الحموض الآتية تكون قاعدتُهُ المرافقة هي الأقوى:HI, H2S, HF
القاعدتُهُ المرافقة الأقوى هي للحمض الأضعف H2S
3) أُحَدِّدُ الجهة التي يُزاح نحوَها الاتزانُ في التفاعل الآتي:
HNO2(aq) + CN-(aq) NO2-(aq) + HCN(aq)
الاتزان يزاح أو يرجح الجهة التي تحتوي المواد الأضعف في التفاعل : وحيث ان الحمض HCN أضعف من الحمض HNO2 وأن القاعدة المرافقة -NO2 أضعف من القاعدة -CN وكلاهما موجودان في جهة المواد الناتجة فان الاتزان يزاح الى جهة المواد الناتجة.
الموادُّ الأمفوتيريّة: Amphoteric Substances
يتأثر سلوكُ المادّة كحِمض أو قاعدة وفقَ مفهوم برونستد - لوري تبعًا لطبيعة الموادّ التي تتفاعل مَعَها وقدرتها على منح البروتون أو استقباله، فبعض الموادّ تسلُكُ كحِمض في تفاعل وتسلُكُ كقاعدة في تفاعلٍ آخَرَ، وتسمّى موادَّ أمفوتيريّة أو مُتردِّدة . فمثلا الماء في التفاعلات السابقة يسلُكُ كقاعدة في تفاعله معَ الحموض، مثل حِمض الهيدروكلوريك HCl، ويسلُكُ كحِمض في تفاعله معَ القواعد، مثل تفاعله معَ الأمونيا NH3؛ وبهذا يُعَدُّ الماءُ مادّةً أمفوتيريّة.
وهناك العديدُ منَ الأيونات السالبة المحتوية على الهيدروجين والقادرة على منحه في التفاعل تسلُكُ سلوكًا أمفوتيريًّا، مثل الأيونات: -HSO3- , HCO3- , H2PO4- , HS، وَتُستثنى من ذلك أيونات -OH، وأيونات الكربوكسيل، مثل: -HCOO و -CH3COO.
فمثلًا، يسلُكُ الأيونُ -HSO3سلوكَ القاعدة عند تفاعله معَ حِمض الهيدروفلوريك HF، كما في المعادلة الآتية:
HSO3- (aq) + HF(aq) H2SO3 (aq) + F-(aq)
حمض قاعدة
ويسلُكُ أيضًا سلوكَ الحِمض عند تفاعله معَ قاعدة، مثل-CN، فهو يمنح البروتون+H إلى أيون CN في أثناء التفاعل وبهذا فإنَّ أيونَ -CN يمثِّلُ القاعدة في التفاعل، والمعادلة الآتية توضِّحُ ذلك:
HSO3-(aq) + CN-(aq) SO32-(aq) + HCN(aq)
قاعدة حمض
اجابة سؤال أتحقق:
أكتبُ معادلتين كيميائيتين أُوَضِّحُ فيهما سلوكَ الأيون -HCO3 معَ كلٍّ من -OH و HNO2.
HCO3-(aq) + OH-(aq) CO32-(aq) + H2O(l)
قاعدة حمض
HCO3-(aq) + HNO2(aq) H2CO3(aq) + NO2-(aq)
حمض قاعدة
مفهومُ لويس Lewis Concept
فَسَّرَ مفهومُ برونستد-لوري سلوكَ الحِمض والقاعدة بالاعتماد على انتقال البروتون (+H) منَ الحِمض إلى القاعدة، إلا أنه لم يوضِّح كيفيّة ارتباط البروتون بالقاعدة، كما أنَّ هناك العديد من تفاعلات حِمض- قاعدة لا تشتملُ على انتقال للبروتون، مثل تفاعل بعض الأيونات الفلزيّة معَ الماء أو الأمونيا .
فكيف يمكن تفسير سلوك هذه الموادّ؟ وكيف عرَف لويس كل من الحمض والقاعدة؟
درس لويس تفاعلات الحموض والقواعد التي لا تشتملُ على انتقال للبروتون،ووضع تصوُّرًا جديدًا لمفهوم الحِمض والقاعدة
بالاعتماد على انتقال أزواج الإلكترونات منَ القاعدة إلى الحِمض؛ وقد عَرَّفَ كل من الحمض والقاعدة كما يلي:
الحِمض : مادّةٌ يمكنُها استقبالُ زوج منَ الإلكترونات في أثناء التفاعل،
القاعدة : مادّة يمكنُها منحُ زوج منَ الإلكترونات في أثناء التفاعل.
ساعد هذا المفهوم على تفسير تكوين الرابطة في تفاعل الحِمض HCl معَ القاعدة NH3؛
فأيونُ الهيدروجين+H (البروتون) الناتجُ من تأيُّن الحِمض يمتلكُ فلكًا فارغًا،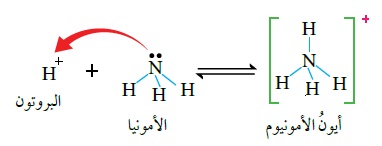
بينما تمتلكُ ذرّةُ النيتروجين في الأمونيا NH3 زوجًا غيرَ رابط منَ الإلكترونات،
وعند انتقال البروتون +H إلى الأمونيا NH3 فإنه يستقبلُ زوج إلكترونات غير رابط في ذرّة النيتروجين، ويرتبط بها، فتنشأ بينهما رابطةٌ تناسقيّة، ويتكوَّنُ أيونُ الأمونيوم موجبُ الشحنة +NH4.
ويمكن تمثيلُ التفاعل الحاصل بينهما على كما يتضح من المعادلة في الرسم المبين.
وهذا يشير الى أن الحمض يمتلك أفلاكأ فارغة، والقاعدة تمتلك أزواج الكترونات غير رابطة.
يَتَّضِحُ ممّا سبق أنَّ مفهوم لويس استُخدم في تفسير تفاعلات حِمض - قاعدة التي ينطبقُ عليها مفهومُ برونستد - لوري، وتفاعلات أخرى لا ينطبق عليها مفهومُ برونستد – لوري، مثل:تفاعل الأمونيا NH3 معَ ثلاثي فلوريد البورون BF3، الذي يُعَبَّرُ عنه بالمعادلة الآتية: 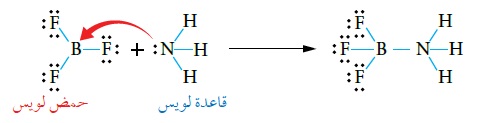
فذرة النيتروجين N تمتلكُ زوجَ إلكترونات غير رابط في NH3 يمكنها منحه؛ وبهذا فإنَّ NH3 تمثِّلُ القاعدة،
في حين أنَّ لدى ذرّة البورون B في BF3 فلكًا فارغًا يُمَكِّنُها منَ استقبال زوج منَ الإلكترونات؛ وبهذا فإنَّ BF3 يمثِّلُ الحِمض.
كما تمكَّنَ لويس من تفسير تكوين الأيونات المعقدة التي تنتُجُ من تفاعل أيونات بعض الفلزّات معَ جُزيئات مثل H2O أو NH3 أو معَ أيونات أخرى مثل-CN.
فمثلا، يتفاعل أيونُ +Cu2 معَ الماء H2O لتكوين الأيون +Cu(H2O)62، كما في المعادلة الآتية:
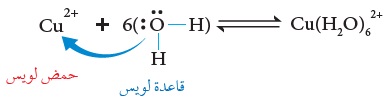
حيث يمتلكُ أيونُ النحاس+Cu2 أفلاكًا فارغة؛ ولذلك يمكنُهُ استقبالُ زوج أو أكثرَ منَ الإلكترونات منَ الماء؛ وبهذا فهو يمثِّلُ الحِمض في التفاعل، أمّا جزيءُ الماء H2O فتمتلكُ ذرّةُ الأكسجين فيه زوجين غير رابطين منَ الإلكترونات يمكنها منحُ أحدهما لأيون النحاس+Cu2؛ وبهذا فالماءُ يمثِّلُ القاعدة في التفاعل؛ لِذا يرتبطُ أيونُ النحاس+Cu2 عن طريق أفلاكه الفارغة بعدد من جُزيئات الماء عن طريق أزواج الإلكترونات غير الرابطة بروابطَ تناسقيّة مكوِّنًا الأيونَ +Cu(H2O)62.
وكذلك يمكنُ تفسيرُ تفاعل أيون الفضَّة (+Ag ) معَ أيونات السيانيد -CN لتكوين الأيون -Ag(CN)2 ، كما في المعادلة الآتية:
Ag+(aq) + 2CN- (aq) Ag(CN)2-(aq)
قاعدة حمض
فأيونُ الفضَّة الموجب +Ag يمتلكُ أفلاكًا فارغة، بينما يمتلكُ أيون السيانيد السالب-CN أزواج إلكترونات غير رابطة؛
وبهذا فإنَّ أيون الفضَّة +Ag يستقبلُ أزواج الإلكترونات ويمثل حِمضَ لويس في التفاعل، في حين أنَّ
كلَّ أيون سيانيد -CN يمنحُ أيونَ الفضَّة زوجَ إلكترونات غير رابط ويمثلُ قاعدة لويس في التفاعل.
اجابة سؤال أتحقق:
1( أُحَدِّدُ الحِمض والقاعدة حَسَبَ مفهوم لويس في كلٍّ منَ التفاعلات الآتية:
Ag+(aq) + 2NH3 (aq) Ag(NH3)2+(aq)
قاعدة لويس حمض لويس
B(OH)3(aq) + OH-(aq) B(OH)4-(aq)
قاعدة لويس حمض لويس
Ni2+(aq) + 6H2O(aq) Ni(H2O)62+(aq)
قاعدة لويس حمض لويس