|
الوحدة 7 الفيزياء النووية |
 |
|
أتأمل الصورة الفيزياء والطاقة إذ تُعدّ الطاقة النووية من مصادر الطاقة طويلة الأمد. النوويّة؟ وما القوانين والأسس الفيزيائيّة التي ترتبط بهذه التكنولوجيا؟ أهم الشروط الواجب توافرها في المناطق التي تبنى فيها المفاعلات النووية، بعدها عن المناطق المأهولة بالسكان وبناؤها في مناطق تتوافر فيها كميات |
|
تجربة استهلالية استقصاء التفاعل المتسلسل |
|
|
النموذج الأول: 1.أرتّب قطع الدومينو كما في الشكل المجاور، على أن تكون كل قطعة مواجِهة لقطعتين من الدومينو. أن تسقط نحو القطعتين المقابِلتين لها، وأقيس الزمن اللازم لسقوط القطع جميعها. |
 |
|
النموذج الثاني: 1. أرتّب قطع الدومينو مجددا كما في الشكل المجاور، على أن تُسقِط القطعة الأولى قطعتي الدومينو في الصف الثاني، وتُسقِط قطعة واحدة من الصف |
 |
|
التحليل والاستنتاج: جميعها في النموذجين. المتوسط الزمني لسقوط القطع جميعهت في النموذج الأول أقل. سقوطها فأيّ النموذجين تكون كميّة الطاقة الناتجة في وحدة الزمن أكبر؟ كمية الطاقة الناتجة في وحدة الزمن أكبر في النموذج الأول. انشطار نواة، فأيّ النموذجين يمثّل تفاعلاً يمكن السيطرة عليه؟ معدل سقوط قطع الدومينو ( انشطار النوى) في النموذج الثاني أقل، لذلك فمن الأسهل السيطرة عليه مقارنة بالنموذج الأول. |
 |
الدرس 1: تركيب النواة وخصائصها
|
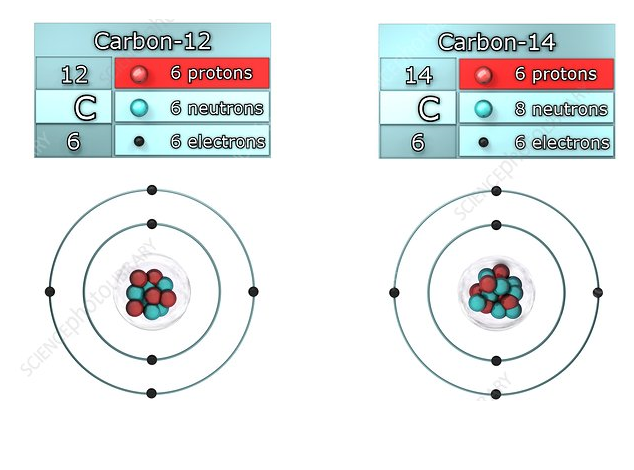
بِنية النَّواة Structure of the Nucleus تتكوّن الذرّة من نواة موجبة الشحنة تتحرّك حولها إلكترونات سالبة الشحنة، ونظرًا إلى أنّ الذرة متعادلة النواة صغير جدًّا مقارنة بحجم الذرة، فإنّ معظم كتلة |
 |
|
مكونات النواة
|
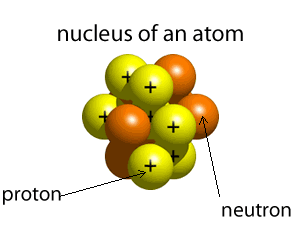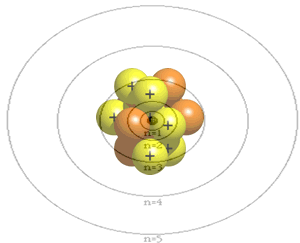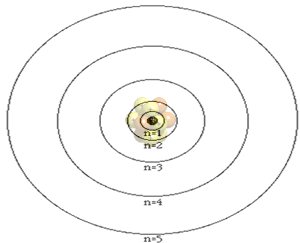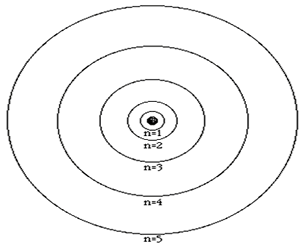 |
 |
|
|
نظائر لذرة الكربون
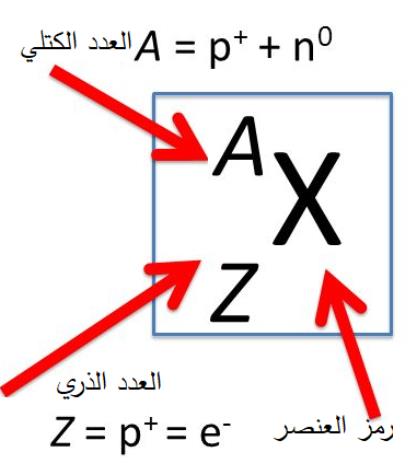
الشحنة الكهربائية للنواة= العدد الذريx شحنة الإلكترون
|
أفكر هل تختلف النظائر عن بعضها في الخصائص الكيميائية أم الفيزيائية؟ تختلف النظائر عن بعضهافي الخصائص الفيزيائية، ولها نفس الخصائص الكيميائية. |
|
كتلة النواة نظرًا إلى صغر كتل النوى، فإن وحدة الكيلوغرام (Kg)غير مناسبة للتعبير عن كتلها، لذا عُرّفت وحدة جديدة تتناسب مع كتل النوى تسمى وحدة الكتل الذرية Atomic mass unit ورمزها (amu) وتساوي من كتلة نظير الكربون():
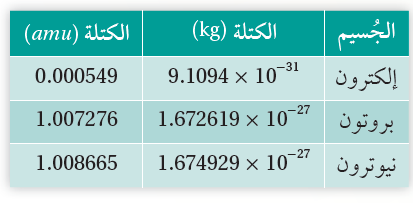
ويوضّح الجدول (1) كتلة كل من البروتون والنيوترون والإلكترون بوحدتي الكيلوغرام (Kg) و وحدة الكتل الذرية(amu)، حيث أضيف الإلكترون من أجل المقارنة. يوضح الجدول أن النواة تتكون من نيوكليونات (بروتونات ونيوترونات) كتلها متقاربة، لذا فإنه يمكن التعبير عن كتلة النواة بدلالة كتلة النيوكليون على النحو الآتي:
حيث : متوسط كتلة النيوكليون وتساوي تقريبا. |
الجدول(1): كتل البروتون والنيوترون والإلكترون
|
|
يتضح من الجدول أن :
|
|
|
مثال: أحسب كتلة البروتون بوحدة الكتلة الذرية الحل: من الجدول: |
|
نصف قطر النواة و حجمها معظم النوى تأخذ شكلا كرويا تقريبا، وأثبتت التجارب العملية أن نصف قطر النواة يتناسب طرديا مع الجذر التكعيبي لعددها الكتلي:
حيث ثابت يساوي تقريبا وعليه فإن حجم النواة (V)يتناسب طرديا مع عددها الكتلي ويعطى بالعلاقة الآتية:
|
مثال: أحسب نسبة نصف قطر النواة إلى نصف قطر النواة
الحل: |
|
كثافة النواة بقسمة كتلة النواة (m) على حجمها (V)أجد أنّ كثافة النواة()لا تعتمد على عددها الكتلي( A )، ما يعني أنّ: كثافة المادّة النووية متساوية في النوى جميعها، وهي تساوي تقريبا: وهي كثافة كبيرة جدًّا، فلو افترضنا أنّ الأرض مصنوعة من مادّة نووية فقط (نيوكليونات)، لكانت كرة نصف قطرها تقريبًا (180m) فقط.
|
أتحقق هل تزداد كثافة النواة بزيادة العدد الكتلي أم تبقى ثابتة؟ تبقى ثابتة لأنها لا تعتمد على العدد الكتلي للنواة |
|
مثال: يمثّل الشكل رسما تخطيطيا لنواة عنصر الكربون ورمزه C، حيث تمثّل الكرات الحمراء البروتونات، والكرات الزرقاء النيوترونات. باستخدام الشكل المجاور أجد ما يأتي: العدد الذريّ، الشحنة الكهربائية للنواة، عدد النيوترونات، العدد الكتلي، عدد النيوكليونات. الحل: العدد الذري يساوي عدد البروتونات ، Z=6 الشحنة الكهربائية للنواة: q =Ze=6x1.6x10-19 =9.6x10-19C عدد النيترونات: N=6 العدد الكتلي: A = Z + N = 6+6 = 12 وهو يساوي عدد النيوكليونات. لذلك تكتب علة شكل: |
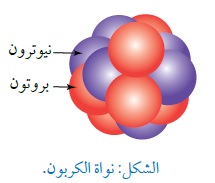 |
|
مثال: أجد لكل من النوى الآتية العدد الذري والعدد الكتلي وعدد النيوكليونات والنيوترونات، وأضعها في جدول: الحل:
|
|
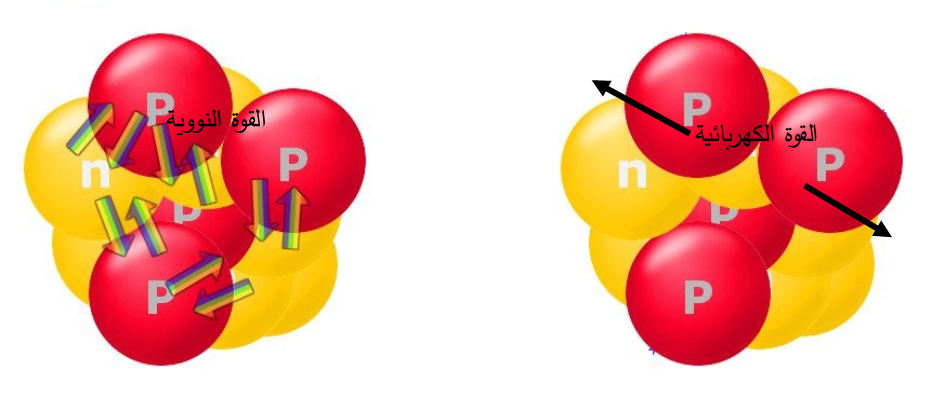
القوة النووية Nuclear Force تتكوّن النواة من نيوترونات متعادلة الشحنة، وبروتونات موجبة الشحنة تنافر كهربائيّة. ولو كانت قوة التنافر الكهربائية هي القوة الوحيدة التي تؤثر في البروتونات، لانفصلت وابتعد بعضها عن بعض، فما الذي يمنع النواة من التفكك؟ لا بدّ من وجود قوة تجاذب بين البروتونات لتتغلّب على قوة التنافر الكهربائية، هذا الكتاب بتسميتها قوة نووية، وهي:
بروتون وبروتون، نيوترون وبروتون، نيوترون ونيوترون.
من بعض. فإذا زادت المسافة بين نيوكليون وآخر عن (3fermi) فإنها تنعدم تقريبا.علما بأن ؛ حيث تُستخدم هذه الوحدة في الفيزياء النووية نظرًا إلى أنّ المسافات متناهية في الصغر على |
|
|
|
لو كانت قوة التنافر الكهربائية بين البروتونات هي القوة الوحيدة التي تؤثر بين مكونات النواة، لانفصلت عن بعضها، لذا لا بد من وجود قوة تجاذب تنشأ بين مكونات النواة تتغلب على قوة التنافر الكهربائية، وهذه القوة هي القوة النووية. |
|
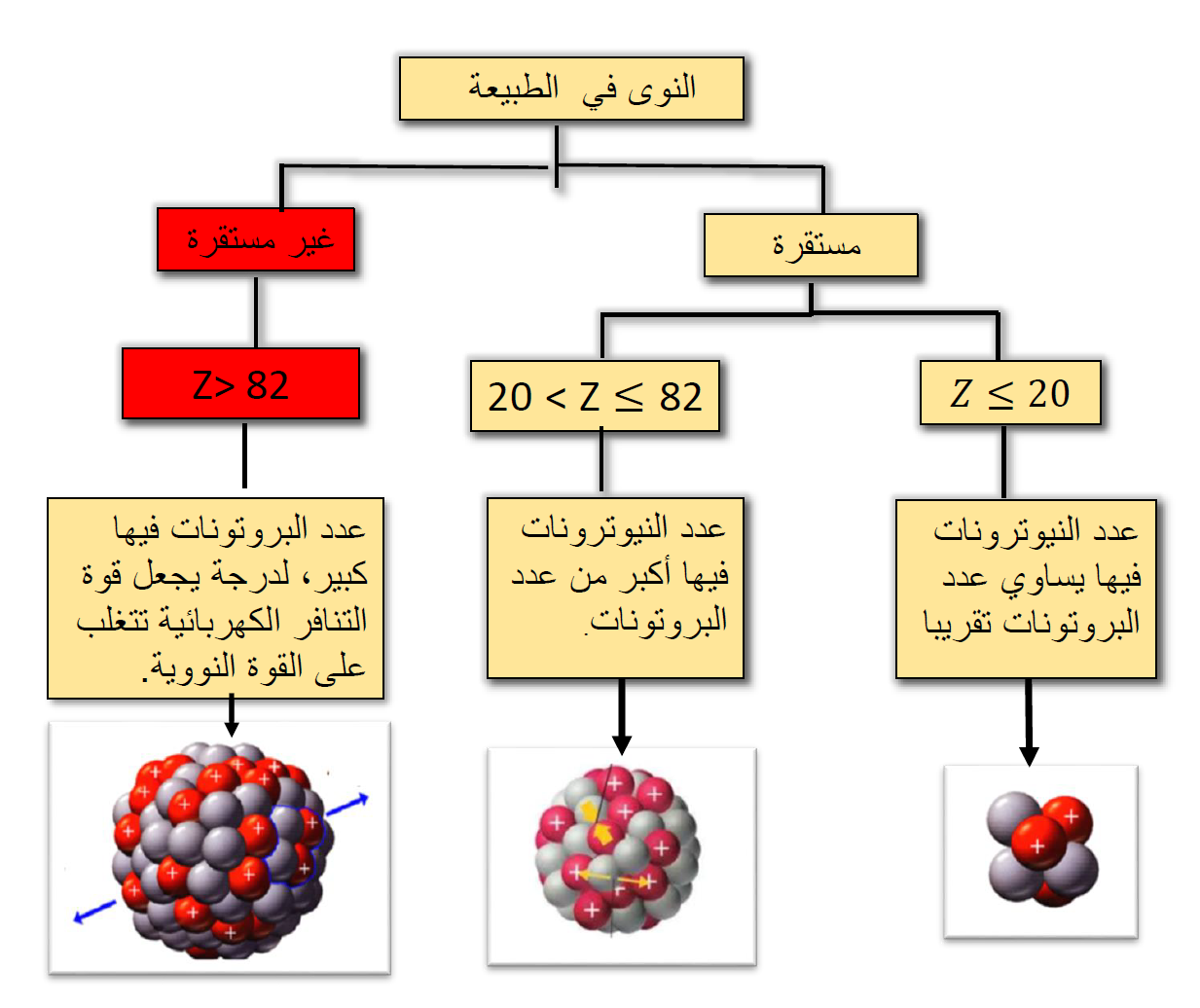
النوى المستقرة والنوى غير المستقرة يوجد في الطبيعة العديد من النوى المستقرة التي تبقى على حالها بمرور الزمن، ويوجد أيضًا نوى أخرى نوويّة، وتتحول إلى نوى أخرى أكثر استقراراً، على إن استقرار النواة يخضع لعوامل عدّة؛ أحدها نسبة |
 |
| استقصاء نسبة () في النوى المستقرة | ||||||||||||||||||||||||||||||||
على البروتونات فقط أن تكون مستقرة؛ لأن قوة التنافر الكهربائية بين البروتونات ستؤدي إلى عدم استقرار النواة. (باستثناء ذرة الهيدروجين التي تتكون نواتهامن بروتون واحد فقط).
لأن النيوترونات متعادلة كهربائيًّا؛ لذا، فإنها تسهم في إضافة قوة تجاذب نووية دون أن تزيد من قوة التنافر الكهربائية داخل النواة.
يوضح عدد البروتونات وعدد النيوترونات ونسبة ()لبعض النوى المستقرة.
عند استقصاء نسبة () للنوى المستقرة، نتوصل إلى ما يأتي: 1.النوى المستقرة التي يقلّ عددها الذري عن (20) أو يساويه، معظمها تمتلك العدد نفسه من البروتونات والنيوترونات. 2.النوى المستقرة التي عددها الذري أكبر من(20) وأقل من (83) تحوي عددًا 3.تزداد نسبة () مع زيادة العدد الذري للنوى المستقرة التي يقع عددها بين (20) و (82). |
|
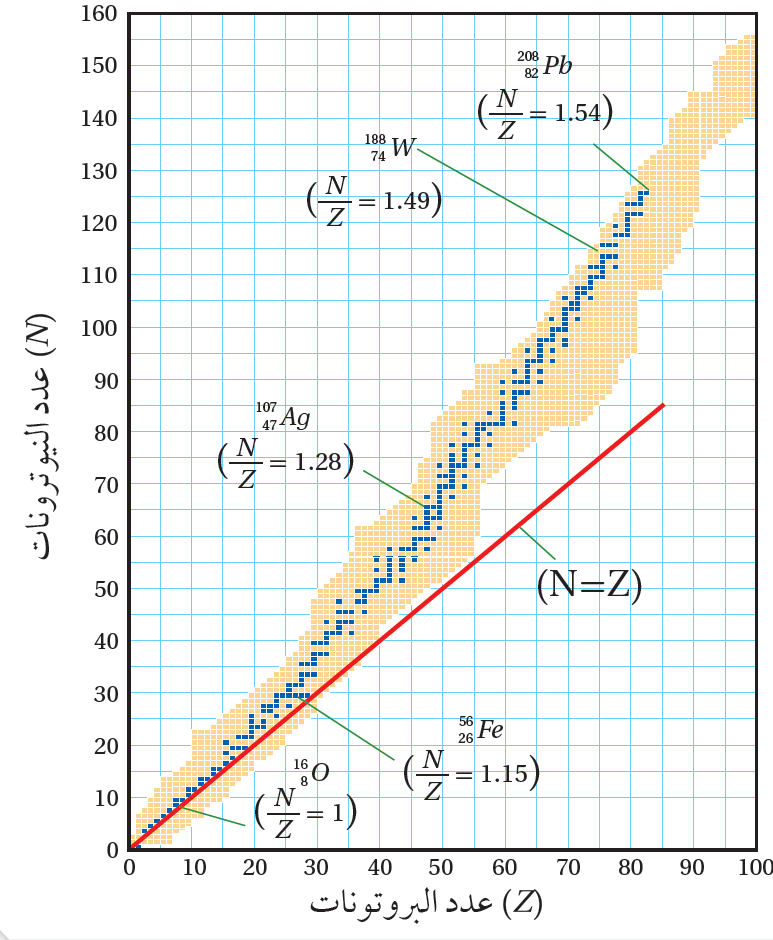
تمثيل العلاقة بين عدد البروتونات وعدد النيوترونات بيانيا. عند تمثيل العلاقة بين عدد البروتونات وعدد يُسمى منحنى، كما هو مبين في الشكل المجاور. أتأمل الشكل وألاحظ أن:
تمثل النقاط البرتقالية النوى غير المستقرة.
يسمى نطاق الاستقرار Stability valley، ممثلا بالنقاط الزرقاء. |
 |
|
ألاحظ من الرسم أن:
معظم النوى المستقرة التي عددها الذري () لها نسبة () مثل بينما هذه النسبة تقريبا تساوي (1) لنواة ().
يكون عدد النيوترونات أكبر من عدد البروتونات؛فعندما يزداد عدد البروتونات، تزداد قوة التنافر بينها، فيتطلب ذلك عددا أكبر من النيوترونات لجعل القوة النووية هي القوة السائدة في النواة ما يؤدي إلى استقرارها. وتزداد النسبة () بزيادة عدد النيوترونات لتصل إلى(1.5)تقريبا لنواة الرصاص()؛ فامتلاك نواة الرصاص (126) نيوترونا مقابل (82) بروتونا يسهم في زيادة القوة النووية، كي تتغلب على قوة التنافر الكهربائية المتبادلة بين البروتونات، ما يؤدي إلى استقرار النواة.
لا يوجد نوى مستقرة عددها الذري أكبر من 82؛ لأن عدد البروتونات يصبح كبيرا فتزداد قوة التنافر الكهربائية، إلى حد تتغلب فيه على قوة التجاذب النووية ما يؤدي إلى عدم استقرار النواة. فزيادة بروتون واحد يؤدي إلى زيادة كبيرة في مقدار قوة التنافر الكهربائي؛ لأنه يتنافر مع ما يزيد عن (82) بروتون. أما إضافة نيوترون واحد فلا يضيف إلا قليلا من قوة التجاذب النووية؛ لأنها قوة قصيرة المدى، والنيوترون الإضافي يتفاعل مع النيوكليونات القريبة منه فقط، ولا يؤثر في النيوكليونات البعيدة عنه. والمخطط الآتي يخلص النتائج التي توصلنا إليها:
|
|
أتحقق ما نسبة () التي تستقرّ عندها النوى التي يقلّ عددها الذري عن 20؟ () لمعظم النوى الخفيفة التي عددها الذري يقل عن أو يساوي 20، لكن هذه النسبة تقريبا تساوي (1) لبعض النوى المستقرة مثل () |
|
طاقة الربط النووية Nuclear Binding Energy ترتبط النيوكليونات داخل النواة بعضها ببعض بقوة التجاذب النووية القوية. فهل يمكن فصل مكونات النواة عن بعضها؟ للإجابة على هذا السؤال سأتعرف أولا على معادلة توصل إليها آينشتين تعرف بتكافؤ (الكتلة -الطاقة)
تكافؤ (الكتلة - الطاقة) بين العالم آينشتين عام (1905) أن الطاقة() ترتبط بالكتلة (m)بالعلاقة الآتية: . حيث: () سرعة الضوء في الفراغ وتساوي كتلة الجسم بوحدة الطاقة المكافئة للكتلة بوحدة وتسمى العلاقة السابقة تكافؤ (الكتلة -الطاقة). خلُص أينشتين إلى أنّ كتلة الجسم هي مقياس لمحتوى الجسم من الطاقة،وتتحوّل الكتلة إلى طاقة أو العكس حسب العلاقة:
حيث ()التغيّر في كتلة الجسم. هذه التغيرات في الكتلة يمكن ملاحظتها على مستوى هو موجود في التفاعلات النووية.وعليه، فإنّه عند دراسة مبدأ حفظ (الكتلة -الطاقة)بدلاً من مبدأ حفظ الطاقة. ونظرًا إلى أنّ سرعة الضوء كبيرة جدًّا، فإنّ تغيّرًا صغيرًا جدا في الكتلة ينتج عنه مقدار هائل من الطاقة.
الطاقة المكافئة لوحدة الكتل الذرية: وحدة الكتل الذرية (amu) تساوي() فإذا تحولت إلى طاقة، فإن الطاقة الناتجة :
أي أن ()تكافئ طاقة مقدارها ().
وبذلك عند استخدام الكتلة بوحدة الكتل الذرية، فإنه يمكن كتابة معادلة تكافؤ (الكتلة - الطاقة) على الصورة:
ومن الناحية العمليّة، فهذه الصورة لمعادلة تكافؤ |
 |
|
كيف أحسب الطاقة إذا كانت الكتلة معطاة بوحدة الكيلوغرام؟ الطاقة المكافئة لكتلة مقدارها():
الطاقة بوحدة الجول |
|
|
كيف أحسب الطاقة إذا كانت الكتلة معطاة بوحدة الكتل الذرية؟ الطاقة المكافئة لكتلة مقدارها ():
الطاقة بوحدة المليون إلكترون فولت. |
|
طاقة الربط النووية وطاقة الربط لكل نيوكليون
ولفصل النيوكليونات بعضها عن بعض يجب تزويدها بطاقة تمكنها من
يجب تزويدها للنواة لفصل مكوّناتها (النيوكليونات) بعضها عن بعض نهائيًّا. |
||
|
كيف أحسب طاقة الربط النووية؟
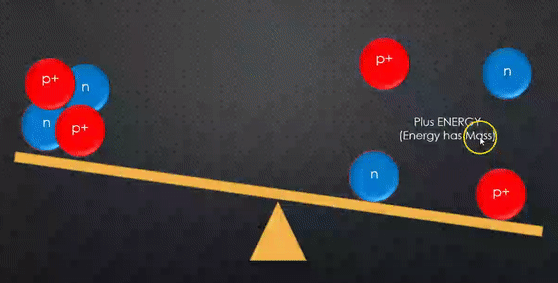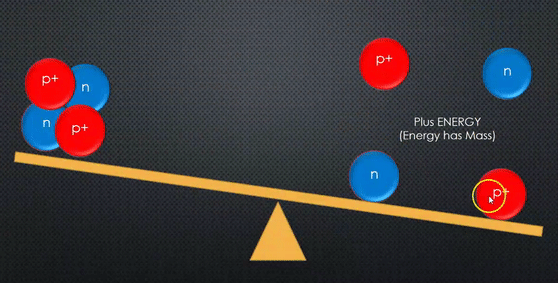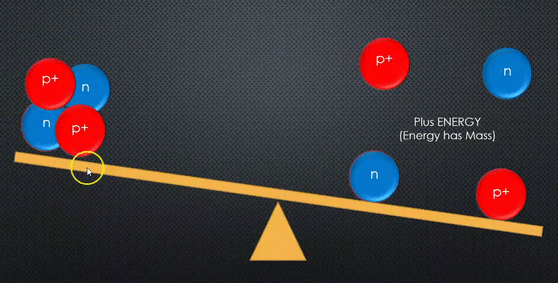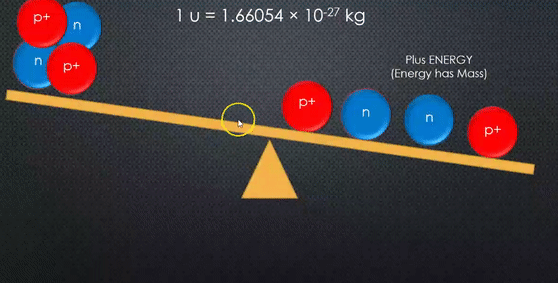
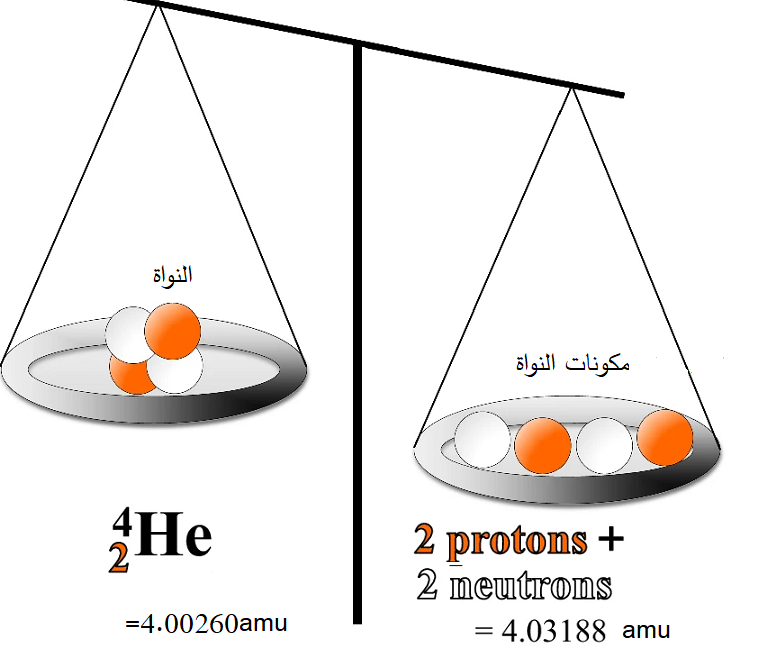
مجموع كتل مكونات النواة دائما أكبر من كتلة النواة.
حيث : كتلة النواة، : كتلة البروتون، : كتلة النيوترون. : العدد الذري(عدد البروتونات)، : عدد النيوترونات
كتلة النواة. |
|
كيف أحسب طاقة الربط النووية؟ مثال: أحسب طاقة الربط النووية لنواة الهيليوم معتمدا على المعلومات المعطاة في الجدول:
لحساب طاقة الربط النووية أتبع الخطوات الآتية:
لنواة ()، عدد البروتونات ()، وعدد النيوترونات( )
أحسب طاقة الربط النووية بوحدة (MeV) : |
مجموع كتل مكونات النواة وهي منفصلة عن بعضها أكبر من كتلة النواة المكونة منها. |
|
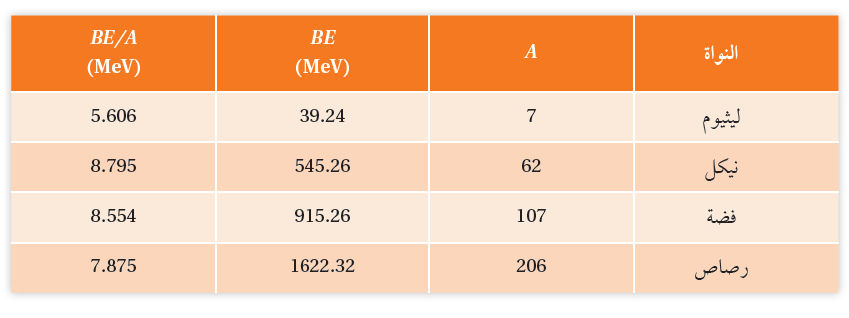
كيف أحسب طاقة الربط لكل نيوكليون؟ عند تزويد النواة بطاقة تساوي طاقة الربط النووية لفصل مكوّناتها كلّها، نيوكليون والتي تُعدّ مؤشراً على استقرار النواة. يبين الجدول الآتي طاقة الربط النووية، وطاقة الربط لكل نيوكليون لبعض النوى، ومن الجدول نستنتج ما يأتي:
الربط النووية.
فهي أكثر استقرارا من النوى الثلاث الأخرى المبينة في الجدول.
|
|
مثال: إذا كان فرق الكتلة بين كتلة نواة () وكتلة مكوناتها () أحسب: طاقة الربط النووية بوحدتي (J) و (MeV). الحل: لحساب الطاقة بوحدة (J):
لحساب الطاقة بوحدة (MeV)،بطريقتين:
تحويل الكتلة إلى وحدة الكتل الذرية ثم حساب الطاقة:
|
|
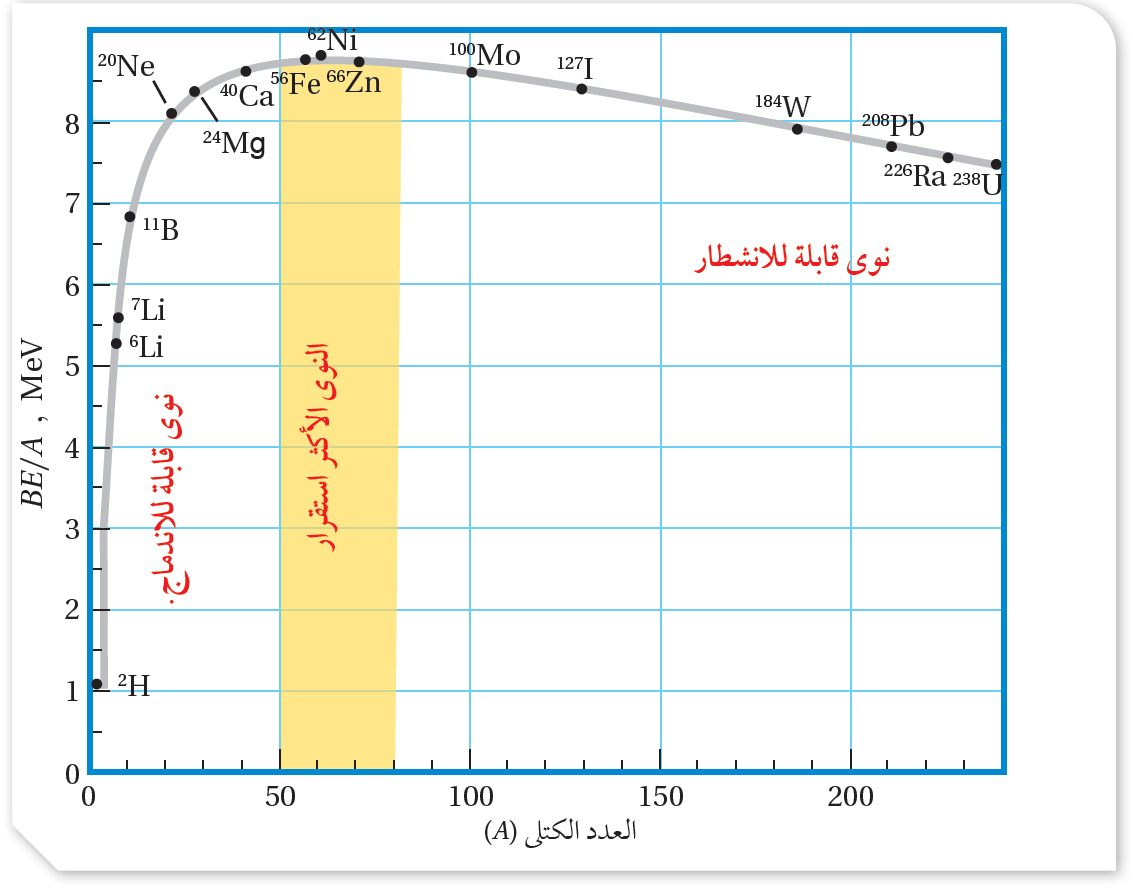
العلاقة بين طاقة الربط لكل نيوكليون والعدد الكتلي
من المنحنى نتوصل ألاحظ أن:
عند نواة النيكل()يليها نواة الحديد ()ما يعني أنهما أكثر استقرارا من غيرهما.
لتكوين نواة أثقل ذات طاقة ربط نوويّة لكل نيوكليون أكبر.
وانشطار النواة الثقيلة ينتج عنه نوى ذات طاقة ربط نوويّة لكل نيوكليون أكبر.
زيادة العدد الكتلي للنوى التي عددها الكتلي ().ويعزى ذلك إلى صغر مدى القوة النووية القوية، لأن النيوكليون يتأثر ببقية النيوكليونات، وهذا ما يعرف بإشباع القوة النووية القوية. مثال: أجد طاقة الربط النووية وطاقة الربط النووية لكلِّ نيوكليون لنواة كلٍّ من ( الرصاص والليثيوم ) علماً أن كتل
الحل:
|
النوى الخفيفة تميل للاندماج كي تصبح أكثر استقرار
|
||||||||||
|
النوى الثقيلة تميل للانشطار، كي تصبح أكثر استقرارا. |