التفاعل الكيميائي: هو تغير يطرأ على المواد المتفاعلة يؤدي إلى إعادة ترتيب الذرات فيها، وإنتاج مواد جديدة تختلف في خصائصها عن المواد المتفاعلة.
المعادلة الكيميائية: تعبير بالرموز أو الكلمات يبين المواد المتفاعلة والمواد الناتجة.
المعادلة الكيميائية اللفظية
تستعمل المعادلة الكيميائية اللفظية للتعبير عن كل من المواد المتفاعلة والمواد الناتجة.
المواد المتفاعلة: المواد التي يبدأ بها التفاعل. المواد الناتجة: المواد التي تنتج عن التفاعل.
# تكتب المعادلة اللفظية على النحو الآتي:
المادة المتفاعلة (1) + المادة المتفاعلة (2) ← المادة الناتجة (1) + المادة الناتجة (2)
مثال:
بروم + ألمنيوم ← بروميد الألمنيوم
المعادلة الكيميائية الرمزية
تستعمل المعادلة الكيميائية الرمزية للتعبير عن كل من المواد المتفاعلة والمواد الناتجة برموز العناصر وصيغ المركبات بدلاً من الكلمات.
# تكتب المعادلة الرمزية على النحو الآتي:
1. أكتب الرموز والصيغ الكيميائية للمواد المتفاعلة يسار السهم.
2. افصل بين المواد المتفاعلة والمواد الناتجة بإشارة +، وأشير إلى الحالة الفيزيائية لكل منها.
3. أكتب الرموز والصيغ الكيميائية للمواد الناتجة يمين السهم.
مثال:
2Al(s) + 3Br2(l) → 2AlBr3(s)
الحالة الفيزيائية:
الصلبة Solid: (s)
السائلة liquid: (l)
الغازية gas: (g)
المحلول aqueous: (aq)
مثال :
يتفاعل الكالسيوم الصلب مع غاز الكلور، وينتج كلوريد الكالسيوم الصلب. أكتب معادلة كيميائية تعبر عن هذا التفاعل.
الحل:
المواد المتفاعلة ← المواد الناتجة
غاز الكلور + الكالسيوم ← كلوريد الكالسيوم
Ca(s) + Cl2(g) → CaCl2(s)
موازنة المعادلة الكيميائية
تعد المعادلة الكيميائية موزونة عندما يكون عدد ذرات كل عنصر متساوياً على طرفي المعادلة.
المعامل: هو رقم يوضع أمام الصيغة الكيميائية في المعادلة، لجعل عدد ذرات كل عنصر متساوياً في طرفي المعادلة، وإذا كان المعامل هو رقم 1 فلا أحتاج إلى كتابته.
مثال 1:
أكتب معادلة كيميائية موزونة لتفاعل غاز الهيدروجين مع غاز النيتروجين لإنتاج غاز الأمونيا.
الحل:
أتبع الخطوات الآتية في موازنة التفاعل الكيميائي:
1. أكتب المعادلة الكيميائية اللفظية للتفاعل:
غاز الهيدروجين + غاز النيتروجين ← غاز الأمونيا
2. أكتب المعادلة الكيميائية الرمزية:
N2 + H2 → NH3
3. أزن المعادلة بجعل عدد ذرات أي عنصر متساوياً في طرفيها.
4. أستخدم المعاملات لموازنة الذرات:
أ- ألاحظ أن المعادلة غير موزونة، لأن عدد ذرات النيتروجين في المواد المتفاعلة يساوي اثنان، وعددها في المواد الناتجة يساوي ذرة واحدة.
ب- لجعل عدد ذرات النيتروجين متساوياً في طرفي المعادلة، أضع الرقم 2 أمام صيغة NH3 لتصبح 2NH3.
ج- أقوم بموازنة ذرات الهيدروجين، وأضع الرقم 3 أمام الصيغة H2 لتصبح 3H2.
N2 + 3H2 → 2NH3
5. أصبحت أعداد ذرات كل عنصر متساوية في طرفي المعادلة، وبذلك تكون المعادلة موزونة.
مثال 2:
أكتب معادلة كيميائية موزونة لتفاعل غاز الهيدروجين مع غاز الأكسجين لإنتاج الماء.
الحل:
أتبع الخطوات الآتية في موازنة التفاعل الكيميائي:
1. أكتب المعادلة الكيميائية اللفظية للتفاعل:
غاز الهيدروجين + غاز الأكسجين ← الماء
2. أكتب المعادلة الكيميائية الرمزية:
O2 + H2 → H2O
3. أزن المعادلة بجعل عدد ذرات أي عنصر متساوياً في طرفيها.
4. استخدم المعاملات لموازنة الذرات:
أ- ألاحظ أن المعادلة غير موزونة، لأن عدد ذرات الأكسجين في المواد المتفاعلة يساوي اثنان، وعددها في المواد الناتجة يساوي ذرة واحدة.
ب- لجعل عدد ذرات الأكسجين متساوياً في طرفي المعادلة، لا أستطيع تغيير صيغة H2O لتصبح H2O2 لأن H2O2 هي صيغة مركب آخر هو فوق أكسيد الهيدروجين، ويختلف تماماً عن الماء H2O.
ج- أقوم بموازنة ذرات الأكسجين، وأضع الرقم 2 أمام الصيغة H2O لتصبح 2H2O.
O2 + H2 → 2H2O
د- أقوم بموازنة ذرات الهيدروجين، وأضع الرقم 2 أمام صيغة H2 لتصبح 2H2.
2H2 + O2 → 2H2O
5. أصبحت أعداد ذرات كل عنصر متساوية في طرفي المعادلة، وبذلك تكون المعادلة موزونة.
أتحقق: من أن عدد ذرات كل عنصر في المواد المتفاعلة متساوياً مع عدد ذرات كل عنصر في المواد الناتجة.
( 4 ذرات H + 2 ذرة O) = ( 2ذرة O + 4 ذرات H)
الفلزات
- تقع في يسار الجدول الدوري ووسطه.
خصائص الفلزات:
1. تتميز بأنها لامعة وصلبة عند درجة حرارة الغرفة.
2. موصلة للتيار الكهربائي.
3. قابلة للسحب والطرق.
4. تتفاوت في نشاطها الكيميائي.
تفاعلات الفلزات مع الأكسجين
* تتفاعل مع الأكسجين في الهواء الجوي، حيث يتغير لون الفلز ويقل لمعانه عند تعرضه للهواء الجوي.
* تفاعل الفلز مع الهواء:
فلز + أكسجين ← أكسيد الفلز
* بعض الفلزات يتفاعل بسرعة مع الأكسجين، مثل الليثيوم، الصوديوم، والبوتاسيوم.
* بعض الفلزات يتفاعل بسرعة أقل مع الأكسجين، مثل: الخارصين، والكالسيوم.
* بعض الفلزات يتفاعل ببطء شديد جداً مع الأكسجين، مثل: النحاس، والنيكل.
مثال:
1. عند قطع الصوديوم بالسكين، فإن السطح يظهر بلون فضي لامع، وخلال دقائق يتفاعل مع الأكسجين، وتتكون طبقة هشة رمادية من أكسيد الصوديوم على سطحه تختلف في خصائصها عن الصوديوم نفسه، وفقاً للمعادلة الآتية:
الصوديوم + الأكسجين ← أكسيد الصوديوم
4Na(s) + O2(g)→ 2Na2O(s)
2. يتفاعل الألمنيوم مع الأكسجين، وتتكون طبقة من أكسيد الألمنيوم تغطي سطحه فتحميه من المواد الموجودة في الهواء الجوي، لذا يستخدم في صناعة الأبواب والنوافذ، وفقاً للمعادلة الآتية:
الألمنيوم + الأكسجين ← أكسيد الألمنيوم
4Al(s) + 3O2(g)→ 2Al2O3(s)
3. يتفاعل الحديد ببطء شديد مع الأكسجين بوجود الماء، وينتج أكسيد الحديد (صدأ الحديد)، وهو مادة هشة بنية ضعيفة تختلف عن الحديد نفسه.
تفاعلات الفلزات مع الماء
- تتفاعل الفلزات مع الماء فتكون هيدروكسيد الفلز وغاز الهيدروجين:
فلز + ماء ← هيدروكسيد الفلز + غاز الهيدروجين
- تتفاوت الفلزات في تفاعلها مع الماء:
1. منها ما يتفاعل بشدة، منتجاً كمية كبيرة من غاز الهيدروجين، مثل الصوديوم والبوتاسيوم.
مثال:
يتفاعل البوتاسيوم مع الماء وفقاً للمعادلة الآتية:
2K(s) + 2H2O(l)→ 2KOH(aq) + H2(g)
المادة الناتجة هيدروكسيد البوتاسيوم KOH تختلف في خصائصها عن فلز البوتاسيوم، حيث إن هيدروكسيد البوتاسيوم ذو ملمس صابوني، في حين أن فلز البوتاسيوم صلب.
2. منها ما يتفاعل بشدة أقل، فتحتاج إلى تسخين لكي تتفاعل مع الماء، مثل الخارصين والكالسيوم.
3. يتفاعل بعضها ببطء شديد مع الماء الساخن، مثل الرصاص والنحاس.
- محاليل أكاسيد الفلزات قاعدية التأثير، تغير ورقة تباع الشمس الحمراء إلى زرقاء.
اللافلزات
- توجد اللافلزات في الجزء العلوي الأيمن من الجدول الدوري.
خصائص اللافلزات:
1. رديئة التوصيل للكهرباء والحرارة.
2. غير قابلة للسحب والطرق.
3. معظمها غازية عند درجة حرارة الغرفة.
4. بعضها صلبة هشة أو سائلة.
تفاعلات اللافلزات مع الأكسجين
* تتفاعل اللافلزات مع الأكسجين مكونة أكسيد اللافلز، كما في المعادلة الآتية:
اللافلز + الأكسجين ← أكسيد اللافلز
مثال:
1. يتفاعل غاز النيتروجين مع غاز الأكسجين وفقاً للمعادلة الآتية:
N2(g) + 2O2(g) → 2NO2(g)
2. يتفاعل الكربون مع الأكسجين وفقاً للمعادلة الآتية:
2C(s) + O2(g) → 2CO(g)
- محاليل أكاسيد اللافلزات حمضية التأثير تغير ورقة تباع الشمس الزرقاء إلى حمراء.
أفكر: صفحة (87)
أيُّ الشكلين الآتيين يمثل تفاعلا كيميائيا؟ أفسر إجابتي.
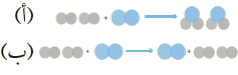
الإجابة: الشكل (أ) ، لإنه أدى لتكوين مواد جديدة
أتحقق: صفحة (88)
يتفاعل المغنيسيوم الصُّلب مع غاز الكلور، وينتج كلوريد المغنيسيوم الصُّلب، أكتب معادلة كيميائية لفظية ورمزية تعبر عن هذا التفاعل.
الإجابة:
أتحقق: صفحة (90)
أزن المعادلة الكيميائية الآتية: Na + Cl2 → NaCl
الإجابة: 2Na + Cl2 → 2NaCl
أتحقق: صفحة (93)
أكتب معادلة لفظية تمثل التفاعل الحاصل بين الليثيوم والأكسجين.
الإجابة:
تجربة تفاعل الفلزات مع الأكسجين صفحة (94)
التحليل والاستنتاج:
- أفسر سبب الاختلاف بين الموادِّ في التفاعل.
الإجابة: المغنيسيوم فلز لامع، الاكسجين غاز أكسيد المغنيسيوم صلب لونه ابيض
- أكتب معادلة التفاعل اللفظية والرمزية.
الإجابة:
- أزن معادلة التفاعل الكيميائيِّ.
الإجابة:
أفكر: صفحة (95)
يحفظ البوتاسيوم مغموسا في الكيروسين أو زيت البرافين، لماذا؟
الإجابة: يحفظ البوتاسيوم تحت الكيروسين او زيت البرافين لمنع وصول اكسجين الهواء والماء الى البوتاسيوم؛ لان البوتاسيوم شديد التفاعل مع الاكسجين والماء.
أتحقق: صفحة (95)
أكتب معادلة لفظية للتفاعل الحاصل بين المغنيسيوم والماء.
الإجابة:
أفكر: صفحة (96)
لماذا ينصح بتهوية الغرف التي تستخدم فيها المدافئ التي تعمل باستخدام الكاز في فصل الشتاء؟
الإجابة: لأن احتراق الكاز (الوقود) سينتج ثاني أكسيد الكربون او اول أكسيد الكربون مما يسبب الاختناق لذا يجب تهوية الغرفة باستمرار.
أتحقق: صفحة (96)
هل ( C + O2 ) هو نفسه (CO2)؟
الإجابة: لا
تجربة تفاعل اللافلزات مع الأكسجين صفحة (97)
التحليل والاستنتاج:
- أفسر سبب الاختلاف بين الموادِّ في التفاعل.
الإجابة:الكبريت صلب هش لونه اصفر ، الاكسجين غاز ، أكسيد الكبريت غاز
- أستنتج الأدلة على حدوث تفاعل كيميائيٍّ.
الإجابة: تصاعد غاز أكسيد الكبريت SO2
- أكتب معادلة التفاعل اللفظية والرمزية.
الإجابة:
التفكير الناقد:
أتوقع تأثير المادة الناتجة، أهو حمضيٌّ أم قاعديٌّ؟
الإجابة: حمضي التأثير