المادة ومكوناتها
- كل ما يحيط بنا من أشياء صلبة وسائلة وغازية عبارة عن مواد.
المادة: هي كل شيء له كتلة ويشغل حيزاً في الفراغ، وأدركه بحواسي.
- تتكون المادة من عناصر.
- العنصر: مادة تتكون من نوع واحد فريد من نوعه من الذرات.
- الذرة: أصغر جزء في المادة وغير قابل للتقسيم بالطرائق الفيزيائية والكيميائية البسيطة.
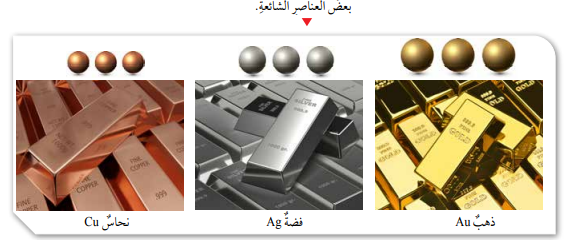
- على سبيل المثال: يتكون عنصر الحديد من ذرات الحديد فقط، يتكون عنصر الألمنيوم من ذرات الألمنيوم.
- لكل عنصر اسم ورمز خاصان به، مثل الهيدروجين (H)، الكربون (C)، والذهب (Au).
أكتشف العلماء أن الذرات تتكون من ثلاثة جسيمات، جسمين مشحونين هما الإلكترون والبروتون، وجسيم متعادل لا يحمل شحنة هو النيوترون.
وهذه الجسيمات متناهية في الصغر ولها كتل صغيرة، إذ اكتشفوا أن للبروتون كتلة مساوية لكتلة النيوترون تقريباً، لكن كتلة الالكترون أصغر بكثير من كتلة أي منهما.
مكونات الذرة
الالكترونات: جسيمات غير مرئية ومتناهية في الصغر، تحمل شحنة سالبة في الذرة، اكتشف وجودها العالم ثومسون.
أثبتت التجارب أن الالكترون جسيم سالب الشحنة يدور في الفراغ الموجود في الذرة ويرمز إليه بالرمزe- ، وكتلته تساوي 9.11 ×10-28 g، وهي أقل بكثير من كتلة البروتون.
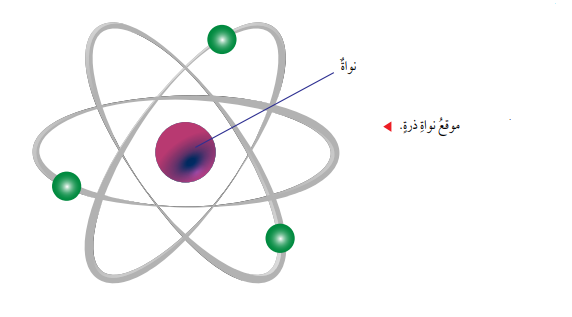
أجرى العالم رذرفورد عدة تجارب توصل من خلالها إلى أن معظم حجم الذرة عبارة عن فراغ، وأن كتلة الذرة تتمركز في النواة.
النواة: حيز متناهٍ في الصغر يقع في مركز الذرة، يوجد بداخلها جسيمات موجبة الشحنة تسمى بروتونات.
البروتونات: جسيمات موجبة الشحنة، غير مرئية، متناهية في الصغر تحمل شحنة مساوية لشحنة الالكترونات، لكنها موجبة، وهذا مايعطي التعادل الكهربائي لذرة أي عنصر.
- كتلة البروتون الواحد تساوي 1.673 × 10-24 g ، ويرمز إليه بالرمز P+.
أجرى العالم شادويك تجارب نتج عنها اكتشاف وجود النيوترونات.
النيوترونات: جسيمات غير مرئية توجد في النواة، متناهية في الصغر ومتعادلة لا تحمل أي شحنة،.
- كتلة النيوترون الواحد تساوي كتلة البروتون تقريباً، ويرمز إليه بالرمز n .
أتحقق صفحة 49: أقارن بين الجسيمات الثلاثة المكونة للذرة، من حيث الموقع، والشحنة، والكتلة.
الجواب :
|
|
الموقع |
الشحنة |
الكتلة |
|
الالكترونات |
في الفراغ الموجود حول الذرة |
سالبة |
9.11×10-28 g |
|
البروتونات |
في داخل النواة |
موجبة |
1.673×10-24 g |
|
النيوترونات |
في داخل النواة |
لا تحمل شحنة |
1.673×10-24 g |
نوى الذرات تختلف فيما بينها
- يتكون العنصر من ذرات، ولكل عنصر ذراته المميزة له، لكن كيف تختلف نوى ذرات العناصر عن بعضها؟
- تختلف العناصر في عددها الذري، وعددها الكتلي، وعدد النيوترونات.
العدد الذري
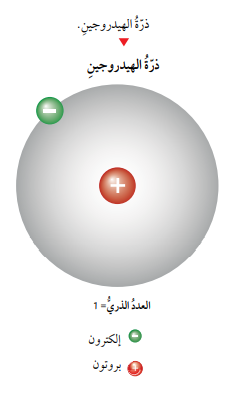
العدد الذري: هو عدد البروتونات الموجودة في نواة أي عنصر، ويساوي عدد البرتونات الموجبة عدد الإلكترونات السالبة في الذرة المتعادلة.
- لكل عنصر عدد بروتونات مختلف عن العنصر الآخر.
- فسر: ذرات العناصر متعادلة لا تحمل شحنة.
الجواب: أن عدد الإلكترونات السالبة يساوي عدد البروتونات الموجبة في النواة.
- على سبيل المثال، تحتوي ذرة الهيدروجين على برتون واحد في نواتها، لذا، فإن العدد الذري لعنصر الهيدروجين يساوي 1، ومن ثم سوف يكون لذرته إلكترون واحد . أيضاً تحتوي ذرة الكربون على 6 بروتونات في نواتها، لذا فإن العدد الذري لعنصر الكربون يساوي 6، وبذلك سيكون لذرته 6 الكترونات أيضاً.
- وبذلك، تتميز ذرات العناصر بعضها عن بعض بعدد بروتوناتها، أي أن لكل ذرة عدد بروتونات خاصاً بها وحدها، فلا يوجد عنصران لهما العدد الذري نفسه.
العدد الكتلي
العدد الكتلي: هو مجموع البروتونات والنيوترونات الموجودة في نواة أي ذرة.
لحساب العدد الكتلي نستخدم العلاقة الآتية
العدد الكتلي = عدد البروتونات + عدد النيوترونات
Mass Number = N(p+) + N(n)
مثال: تحتوي نواة أحد العناصر على 7 بروتونات و 7 نيوترونات.
أحسب العدد الكتلي لهذا العنصر.
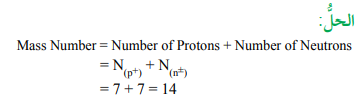
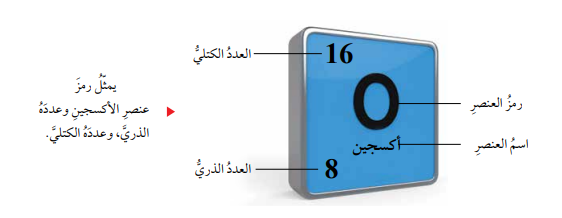
- مثل العلماء العناصر برموز، على أن يكون رمز العنصر عبارة عن حرف أو حرفين باللغة الإنجليزية، ويكتب إلى يساره من الأعلى العدد الكتلي له، في حين يكتب العدد الذري لهذا العنصر إلى يسار رمز العنصر من الأسفل، كما هو موضح في الشكل.
أتحقق صفحة 51: أوضح كيف يحسب العدد الكتلي لأي ذرة.
الجواب: لحساب العدد الكتلي نستخدم العلاقة الآتية
العدد الكتلي = عدد البروتونات + عدد النيوترونات
Mass Number = N(p+) + N(n+)
عدد النيوترونات
يختلف عدد النيوترونات في نوى ذرات العنصر نفسه، أي أن عدد النيوترونات هذا لا يعد عدداً مميزاً للعنصر كعدد البروتونات، وتوجد النيوترونات في نواة ذرة العنصر أيضاً.
على سبيل المثال، تحتوي معظم ذرات الكربون على ستة نيوترونات، في حين قد يحتوي بعضها الآخر على 7 أو 8 نيوترونات كما في الشكل الآتي.
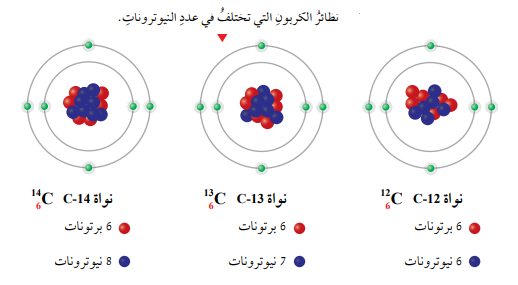
النظائر: ذرات للعنصر لها العدد الذري نفسه، لكن نواها تحتوي على أعداد مختلفة من النيوترونات.

التوزيع الالكتروني
مستويات الطاقة: المناطق التي توجد فيها الالكترونات حول النواة في الذرة المتعادلة .
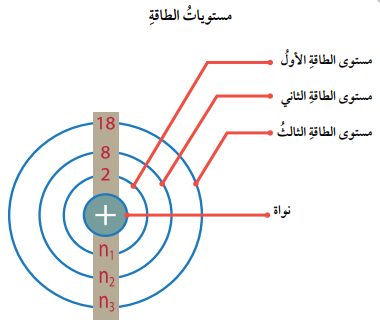
- يتسع كل مستوى لعدد معين من الالكترونات بحسب العلاقة الآتية:
Number of electrons (N(e-)) = 2(n)2
- بهذا، يتسع مستوى الطاقة الأول على الكترونين، ويرمز له ب n1 ، ويتسع مستوى الطاقة الثاني على 8 الكترونات، ويرمز له ب n2..... وهكذا.
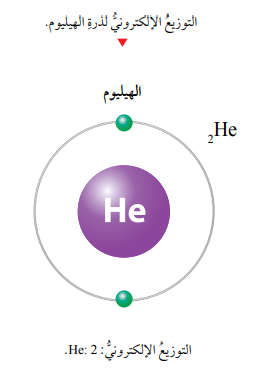
سؤال: ماهو التوزيع الإلكتروني لذرة عنصر الهيليوم (2He).
الجواب: ألاحظ أن الإلكترونين اللذين تمتلكهما ذرة الهيليوم موجودان في مستوى الطاقة الأول الذي يرمز إليه بالرمز n1 ، الذي يتسع لإلكترونين فقط، لذا، يكتب توزيعها الإلكتروني على النحو الآتي: He:2.
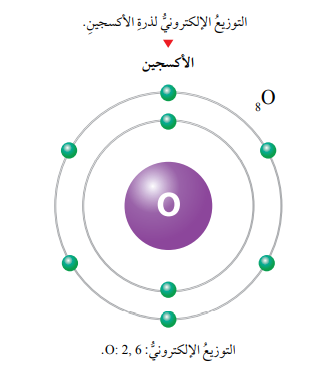
سؤال: ماهو التوزيع الإلكتروني لذرة عنصر الأكسجين (8O).
الجواب: ألاحظ وجود إلكترونين في مستوى الطاقة الأول الذي يرمز له بالرمز n1، الذي يتسع لإلكترونين فقط، وستة إلكترونات في مستوى الطاقة الثاني الذي يرمز إليه بالرمز n2، الذي يتسع ل 8 إلكترونات في حده الأقصى،لذا، يكتب توزيعها الإلكتروني على النحو الآتي: O:2,6.
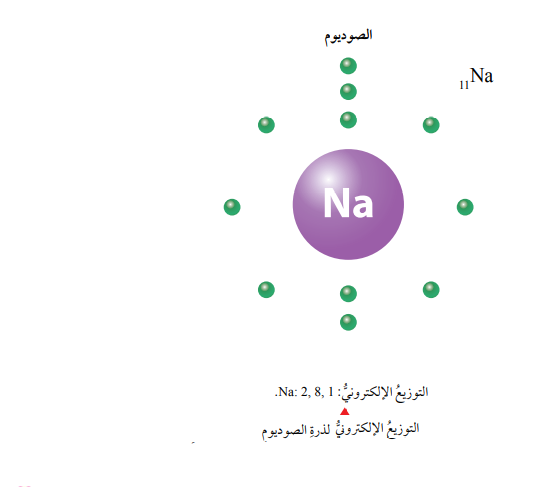
سؤال: ما هو التوزيع الإلكتروني لذرة الصوديوم (11Na).
الجواب: ألاحظ وجود إلكترونين في مستوى الطاقة الأول، وثمانية إلكترونات في مستوى الطاقة الثاني، وإلكترون واحد في مستوى الطاقة الثالث الذي يرمز إليه بالرمز n3، لذا يكتب توزيعها على النحو الآتي: Na: 2,8,1.
أستنتج مما سبق أنه عند رسم التوزيع الإلكتروني وكتابته لأي ذرة متعادلة، أستخدم العدد الذري الذي يساوي عدد الإلكترونات التي توجد في ذرة تلك العنصر، على أن يعبأ مستوى الطاقة الأول بإلكترونين، ثم يعبأ مستوى الطاقة الثاني بثمانية إلكترونات، ثم يعبأ مستوى الطاقة الثالث بثمانية عشر إلكتروناً.
أتحقق صفحة 56: أرسم التوزيع الإلكتروني لذرتي 13Al، و 7N.
الجواب: Al13: 2,8,3
N7: 2,5