نظرية تنافر أزواج إلكترونات مستوى التكافؤ
Valence Shell Electrons Pair Repulsion Theory
* أزواج إلكترونات مستوى التكافؤ Valence Shell Electrons Pair
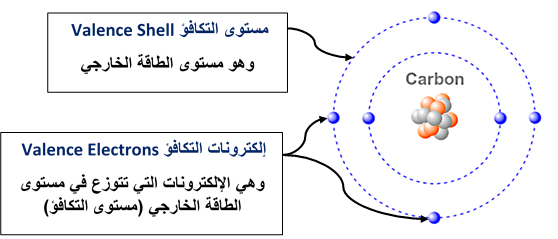
تحدّدُ إلكترونات التكافؤ⇐ نوعَ الرابطة التي تكوّنها الذرّةُ عند تفاعلها معَ ذرّات أُخرى.
* الروابطُ التساهميّة والرابطة التناسقيّة Covalent Bonds and Coordinate Bond
يحتوي المستوى الخارجيُّ لذرّات عناصر المجموعات الممثلة ( 7-4 ) على عدد منَ الإلكترونات تنجذبُ نحو النواة بقوّة.
⦿ فكيف ترتبط ذرتين من هذه العناصر ببعضهما البعض؟
من خلال التشارك في الإلكترونات
⦿ فماذا ينشأ عن ذلك؟
ينشأُ بينهما زوجٌ أو أكثرُ منَ الإلكترونات المشتركة تنجذبُ نحو نواتي الذرّتين معًا.
⦿ ماذا يطلق على قوة الجذب الناشئة؟
يطلق عليها اسم الرابطة التساهمية
مثال: أصف الرابطة المتكونة بين ذرة الكربون وذرة الهيدروجين في الجزيء CH4.
الحل:
6C : 1s22s22p2 , 1H : 1s1
نلاحظ من التوزيع الإلكتروني:
- تمتلك ذرة الكربون في غلافها الخارجي 4 إلكترونات.
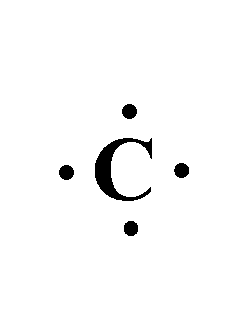
- وتمتلك ذرة الهيدروجين في غلافها الخارجي 1 إلكترون.
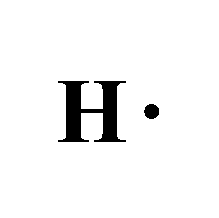
وعند ارتباطهما لتكوين جزيء الميثان ( CH4 ) تتشاركُ ذرّةُ الكربون معَ كلِّ ذرّة هيدروجين بزوج منَ الإلكترونات.
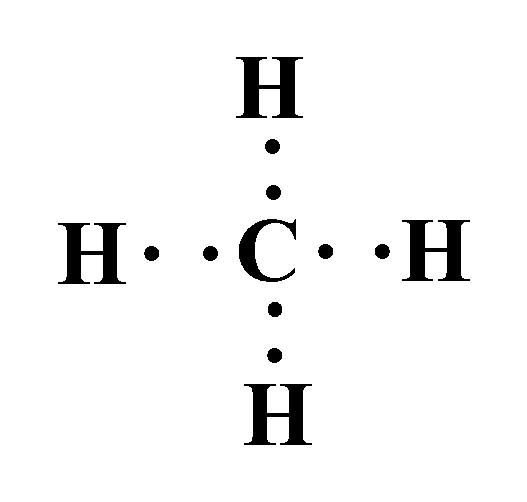
وينشأ عن تشارك هذه الإلكترونات (إلكترونات التكافؤ) أربع روابط تساهمية؛ حيث يشكل كل زوج مشترك رابطة تساهمية أحادية.
⦿ فماذا يطلق على أزواج الإلكترونات المشتركة في تكوين هذه الروابط؟
يطلق عليها اسم أزواج الإلكترونات الرابطة
نلاحظ من المثال أن الروابط جميعها تحيط بذرة الكربون؛ لذلك يطلق على ذرة الكربون اسم الذرة المركزية.
⦿ فماذا نقصد بالذرة المركزية؟
هي تلك الذرّةُ الأقل عددًا في الجزيء المُكَوَّنِ من أكثر من ذرتين وتُكوِن أكثر من رابطة واحدة؛ أي أنها تُحاط بأكبر عدد منَ الروابط في الجزيء.
مثال: أصف الرابطة المتكونة بين ذرة النيتروجين وذرة الهيدروجين في الجزيء NH3.
الحل:
7N : 1s22s22p3 , 1H : 1s1
نلاحظ من التوزيع الإلكتروني:
- تمتلك ذرة النيتروجين في غلافها الخارجي 5 إلكترونات.
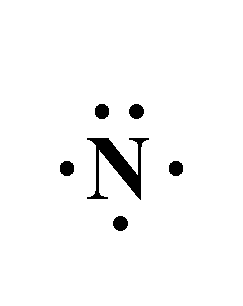
- وتمتلك ذرة الهيدروجين في غلافها الخارجي 1 إلكترون.
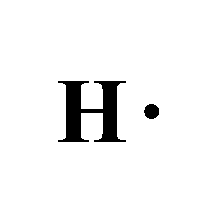
و عند ارتباطهما لتكوين جزيء الأمونيا ( NH3 ) تتشاركُ ذرّةُ الكربون معَ كلِّ ذرّة هيدروجين بزوج منَ الإلكترونات.
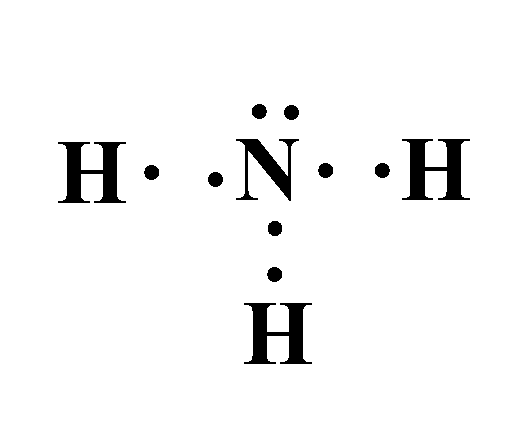
وينشأ عن تشارك هذه الإلكترونات (إلكترونات التكافؤ) ثلاث روابط تساهمية؛ حيث يشكل كل زوج مشترك رابطة تساهمية أحادية.
ويطلق على الإلكترونات المشتركة في تكوين هذه الروابط اسم أزواج الإلكترونات الرابطة
ولكن في هذا المثال نلاحظ وجود زوج واحد من الإلكترونات لم يشارك في تكوين الروابط يطلق عليه زوج الإلكترونات غير الرابطة.
⦿ فماذا نقصد بأزواج الإلكترونات غير الرابطة؟
أزواجٌ منَ الإلكترونات تظهرُ في مستوى التكافؤ للذرّة المركزيّة لا تشارك في تكوين الروابط.
كما نلاحظ من المثال أن الروابط جميعها تحيط بذرة النيتروجين؛ لذلك يطلق على ذرة النيتروجين اسم الذرة المركزية.
من خلال المثالين السابقين نلاحظ أن كل من ذرة الكربون والنيتروجين تحاط بثمانية إلكترونات رابطة وغير رابطة؛ وهذا ما يجعلها تصل إلى حالة من الاستقرار، ويصبح تركيبها مماثلًا لتركيب أقرب الغازات النبيلة.
⦿ فماذا نقصد بقاعدة الثمانية؟
أي أنّ مجموع الإلكترونات في مستوى التكافؤ يساوي ثمانية.
بعض الذرّات التي تكوّنُ روابطَ تساهميّةً في جزيئاتها وتحقّق قاعدة الثمانية
وتركيب لويس لهذه الجزيئات
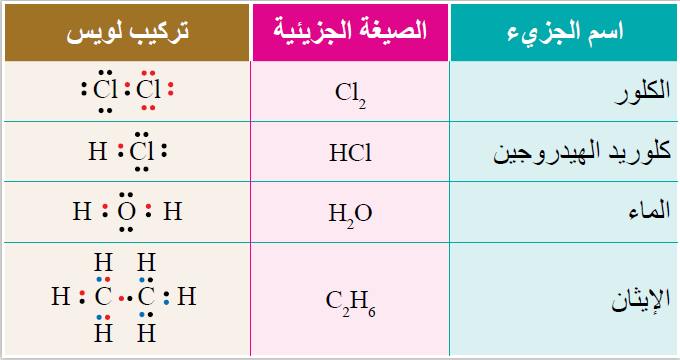
نشاط تطبيقي: أصف الروابط المتكونة في جزيء الماء (H2O)
1- أكتب التوزيع الإلكتروني لذرة الأكسجين (O)
8O : 1s22s22p4
2- أحدد إلكترونات التكافؤ لذرة الأكسجين (O)
v.e = 2 + 4 = 6e-
3- أكتب التوزيع الإلكتروني لذرة (H) ، وحدد إلكترونات التكافؤ.
1H : 1s1 , v.e = 1e-
4- أحدد عدد إلكترونات التكافؤ الكلية؟
Total (v.e) = v.e (O) ╳ n (O) + v.e (H) ╳ n (H)
-Total (v.e) = (6╳ 1) + (1╳2) = 8e
5- احسب عدد أزواج إلكترونات التكافؤ؟
v.e.p = 8 ÷ 2 = 4 أزواج
6- أحدد الذرة المركزية؟ الذرة المركزية ذات العدد الأقل وهي: الأكسجين (O)
7- ارسم تركيب لويس لكل من الأكسجين والهيدروجين؟
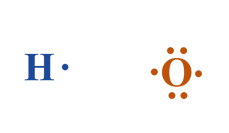
8- أوزع ذرات الهيدروجين حول الذرة المركزية وارسم روابط أحادية في بينها (كل رابطة تمثل زوج من الإلكترونات).
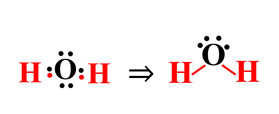
9- أحدد أزواج الإلكترونات غير الرابطة؟
v.e.p – B.e.p = 4 – 2 = 2 زوج
نتيجة النشاط: نلاحظ تكون رابطتين تساهمية أحادية بين الأكسجين (الذرة المركزية) وذرتي الهيدروجين في جزيء الماء، كما نلاحظ تواجد زوجين من الإلكترونات غير الرابطة. وتتحقق قاعدة الثمانية.
مثال: أحددُ عددَ أزواج الإلكتروناتِ الرابطة وغيرِ الرابطة حولَ الذرّة المركزيّة في جُزيء BF3 .
الحل:
أولًا: نكتب التوزيع الإلكتروني لكل ذرة ونحدد عدد إلكترونات التكافؤ.
التوزيع الإلكتروني لذرة B هو 1s22s22p1 وبالتالي فإن عدد إلكترونات التكافؤ = 3
التوزيع الإلكتروني لذرة F هو 1s22s22p5 وبالتالي فإن عدد إلكترونات التكافؤ = 7
ثانيًا: نحدد الذرة المركزية -وهي تلك الذرّةُ الأقل عددًا في الجزيء-
وعليه فإن الذرة المركزية هي ذرة البورون (B).
ثالثًا: نوزع ذرات F حول ذرة B ونضع بينها روابط أحادية.
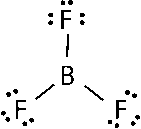
نلاحظ أن ذرة B تحاط بثلاث أزواج من الإلكترونات الرابطة وأنه لا توجد أزواج من الإلكترونات غير الرابطة.
كما نلاحظ أن عددُ الإلكترونات المحيطة بالذرّة المركزيّة أقلَّ من ثمانية؛ وهذا يدل على أن بعض الذرات التي تكون في مركباتها روابط تساهمية لا تحقق قاعدة الثمانية.
# جزيئات تحتوي على روابطَ ثنائيّةٍ أو ثلاثيّة:
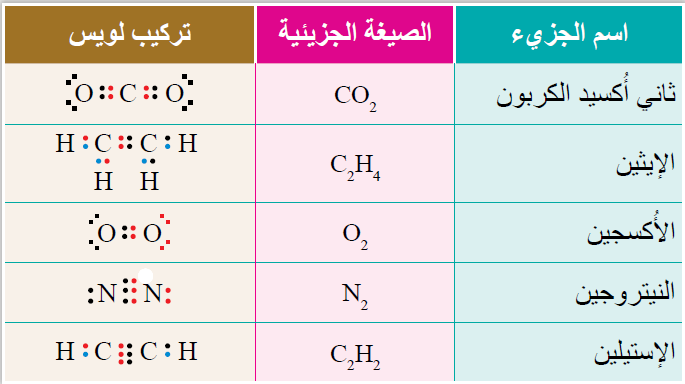
مثال(1): جزيء ثاني أُكسيد الكربون ( CO2 )
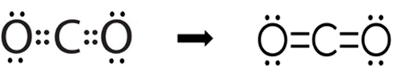
نجد أنّ ذرّة الكربون تتشاركُ معَ كلِّ ذرّة أُكسجين بزوجين منَ الإلكترونات لتكوين رابطة ثنائيّة معَ كلٍّ منهما؛ لكي تُحقّقَ كلٌّ منها قاعدة الثمانية وتصلَ إلى حالة الاستقرار.
مثال(2): جزيء الإيثين C2H4
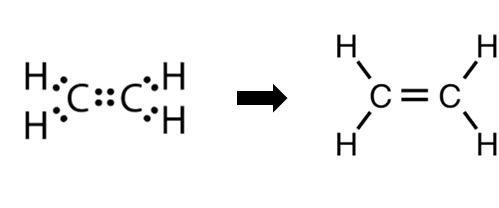
إنّ ذرّتي الكربون في جزيء الإيثين C2H4 تشتركان بزوجين منَ الإلكترونات لتكوين رابطة ثنائيّة؛ لتُحقّقَ كلٌّ منهما قاعدة الثمانية وتصلَ إلى حالة الاستقرار.
مثال(3): جزيء الأُكسجين ( O2 )
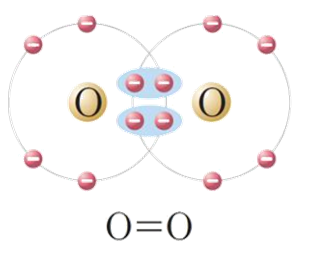
إذ تشتركُ ذرّتاهُ بزوجين منَ الإلكترونات لتكوين رابط ثنائيّة؛ كي تُحقّقَ كلٌّ منهما قاعدة الثمانية وتصلَ إلى حالة الاستقرار.
مثال(4): جزيء ( N2 )
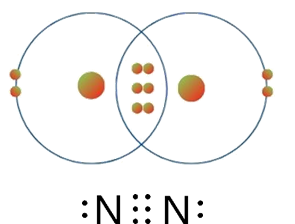
في حين أنّ ذرّتي النيتروجين في جزيء ( N2 ) تتشاركان بثلاثة أزواج منَ الإلكترونات؛ لتكوّنا رابطة ثلاثيّة وتحقّقا -من ثَمَّ- قاعدةَ الثمانية ويصبحَ تركيبُهما مشابهًا لتركيب الغاز النبيل النيون (Ne)
وكذلك ذرّتا الكربون في جزيء الإستيلين C2H2 ، فإنّهما تتشاركان بثلاثة أزواج منَ الإلكترونات وتنشأُ بينَهُما رابطةٌ ثلاثيّة؛ لكي تُحقّقا قاعدة الثمانية وتصلا إلى حالة الاستقرار.
ويبيّنُ الجدولُ الصيغَ الجزيئيّة لهذه الجُزَيئات وتركيبَ لويس لكلٍّ منها.
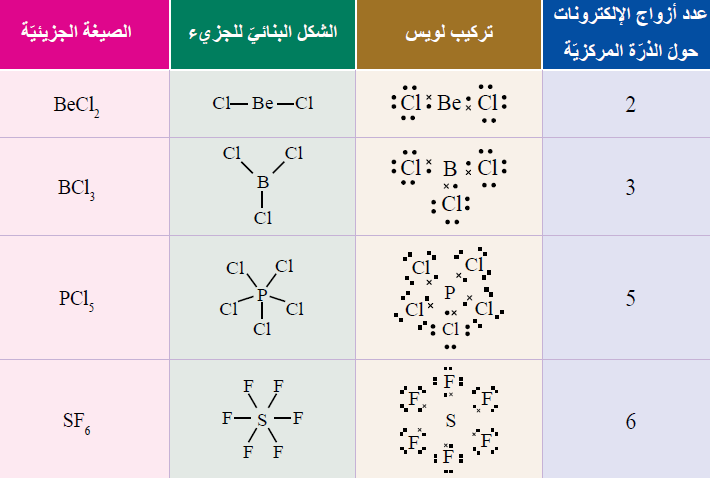
# جزيئات لا تتحقق قاعدة الثمانية:
بعض الذرّات التي تُكَوِّنُ في مركّباتها روابطَ تساهميّةً لا تُحقّق قاعدةَ الثمانية؛ فأحيانًا يكون عددُ الإلكترونات المحيطة بالذرّة المركزيّة أقلَّ من ثمانية. وأحيانًا قد يزيد عددُ الإلكترونات المحيطة بالذرّة المركزيّة على ثمانية.
مثال:
1- عددُ الإلكترونات المحيطة بالذرّة المركزيّة أقلَّ من ثمانية: (BeCl2) ، (BF3) ، (BeH2).
2- عددُ الإلكترونات المحيطة بالذرّة المركزيّة أكثرَ من ثمانية: (PCl5) ، (PBr5) ، (SF6).
⦿ نستنتج مما سبق:
* الرابطة التساهميّة تنشأُ من تشارك ذرَّتين بزوج واحد أو أكثرَ منَ الإلكترونات.
- تشارك زوج واحد يؤدي لتكوين رابطة تساهمية أحادية.
مثال: (CH4) ، (Cl – Be – Cl ) ، (NH3)
- تشارك زوجين يؤدي لتكوين رابطة تساهمية ثنائية.
مثال: (O2) ، (CO2) ، (C2H4)
- تشارك ثلاث أزواج يؤدي لتكوين رابطة تساهمية ثلاثية.
مثال: (N2) ، (C2H2)
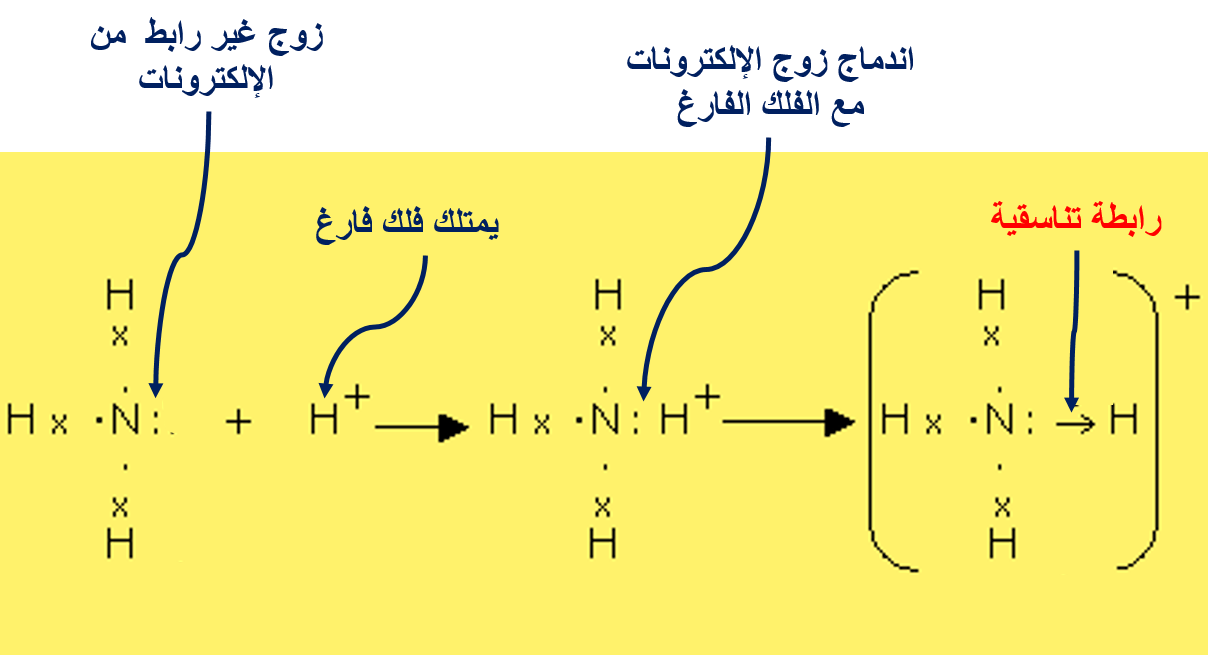
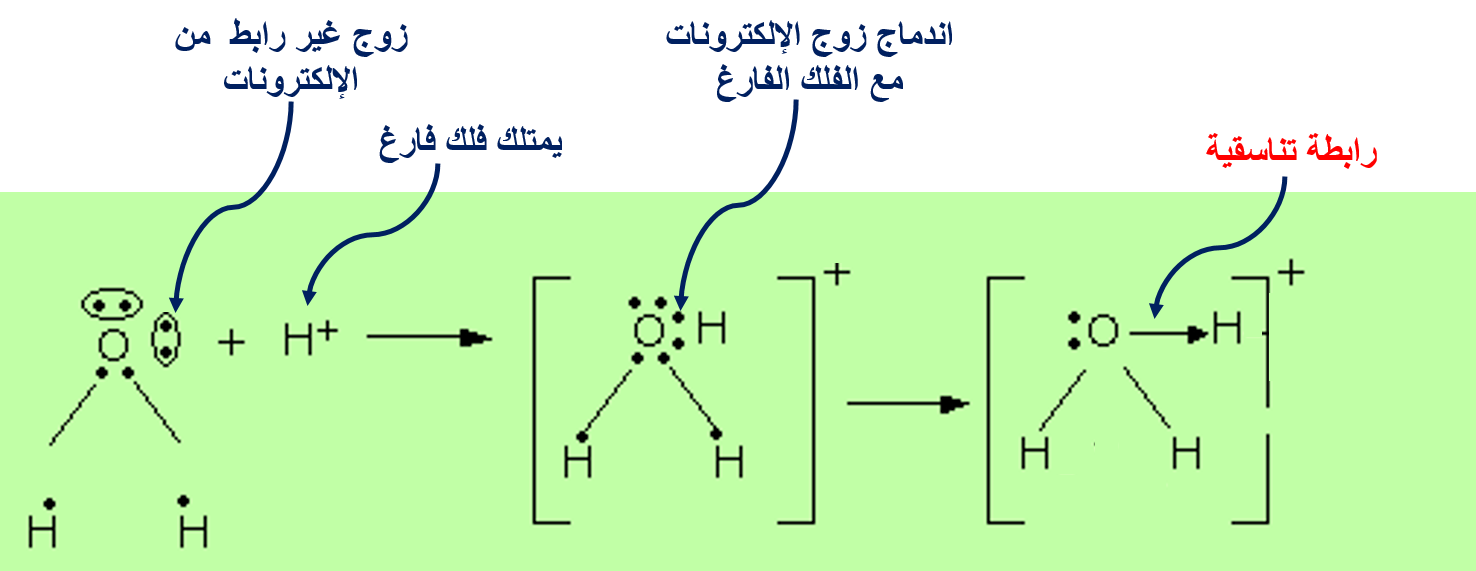
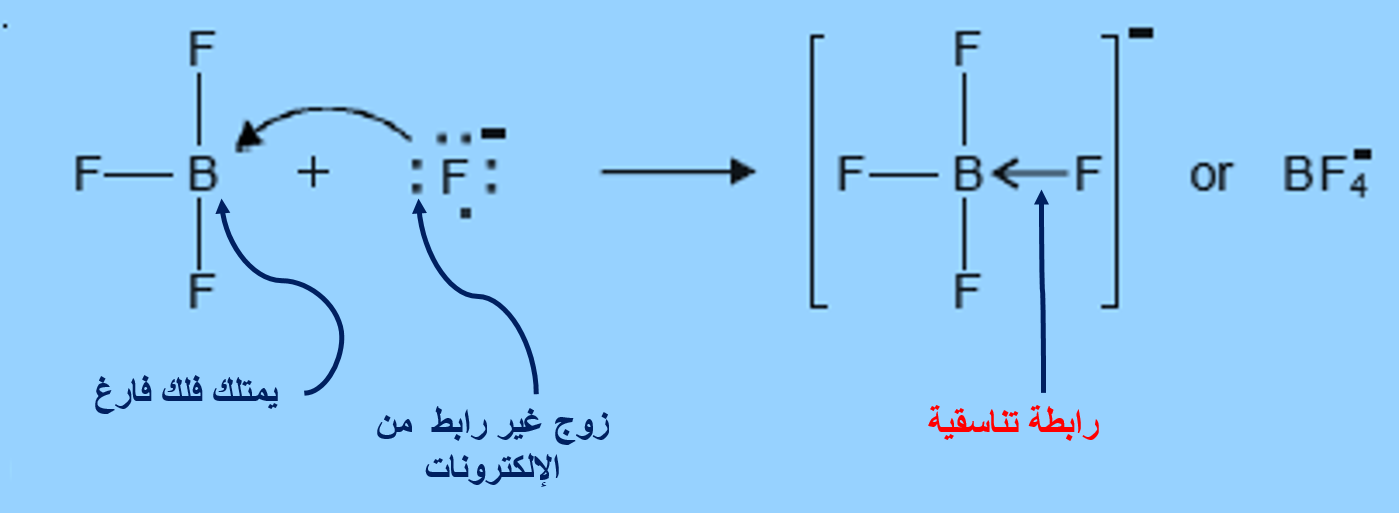
الرابطةَ التناسقيّة Coordinate Bond
هناك نوعًا منَ الروابط التساهميّة ينشأ نتيجة مشاركة إحدى الذرّتين بزوج منَ الإلكترونات في حين تشارك الذرّةُ الأُخرى بفلك فارغ.
ماذا يسمى هذا النوع من الروابط التساهمية؟
الرابطة التناسقية
* تأمل الأمثلة الآتية:
1- NH3(aq) + H+(aq) → NH4+(aq)
2- H2O(aq) + H+(aq) → H3O+(aq)
3- BF3(aq) + F-(aq) → BF4-(aq)
أتحقَّق:ارسُمْ تركيبَ لويس لكلٍّ منَ الجزيئات الآتية، وأحدّد عددَ أزواج الإلكترونات الرابطة وغيرِ الرابطة في ذرّتها المركزيّة: ، OF2 BeH2
H : Be : H
زوجين من الإلكترونات الرابطة ولا يوجد ازواج غير رابطة.
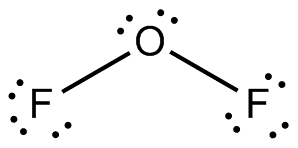
زوجين من الإلكترونات الرابطة وزوجين غير رابطة.
تنافر أزواج إلكترونات مستوى التكافؤ
Valence Shell Electrons Pair Repulsion (VSEPR)
ليكون الجزيء أكثر ثباتًا واستقرارًا يجب أن يتخذ شكلًا فراغيًا يكون فيه التنافر بين بين ازواج الإلكترونات أقل ما يمكن.
بالتالي فإن الشكل الفراغي ينتج من تنافر أزواج الإلكترونات الرابطة وغير الرابطة حول الذرة المركزية في الجزيء.
⦿ فماذا تسمى النظرية التي تستخدم في التنبؤ عن أشكال الجزيئات الفراغي؟
تسمى نظرية تنافر أزواج إلكترونات مستوى التكافؤ (VSEPR)

ترتيبُ أعدادٍ مختلفة من أزواج الإلكترونات حولَ الذرّة المركزيّة ومقدارَ الزاوية بين الروابط والشكلَ المتوقّع
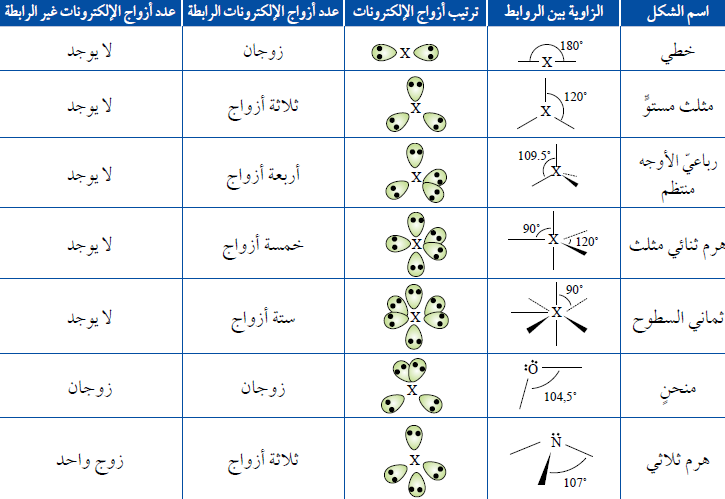
استنتجِ العلاقةَ بين عدد أزواج الإلكترونات حولَ الذرّة المركزيّة ومقدار الزاوية بين الروابط في الجزيء؟ عكسية
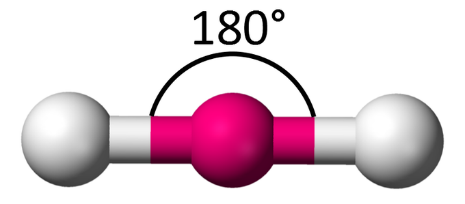
1- الشكل الخطي Linear
عند وجود زوجين منَ الإلكترونات الرابطة فإنّهما سيترتّبان على جانبي الذرّة المركزيّة ليكونَ التنافرُ بينَهُما أقلَّ ما يمكن. وتكونُ الزاوية بينهما (180˚)
أمثلة: (BeH2) ، (BeCl2) ، (BeF2)
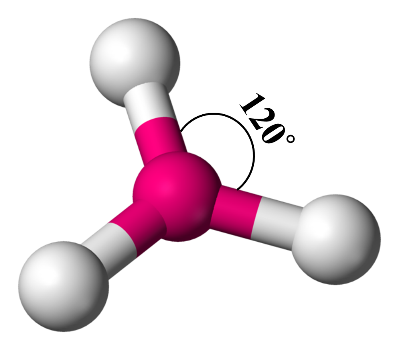
2- مثلّثً مستوِّ Trigonal Planar
في حال وجود ثلاثة أزواج منَ الإلكترونات الرابطة حولَ الذرّة المركزيّة فإنّها سوف تكونُ أبعدَ ما يمكن عندما تكونُ الزاويةُ بينها (120˚)
أمثلة: (BH3) ، (BCl3) ، (BF3)
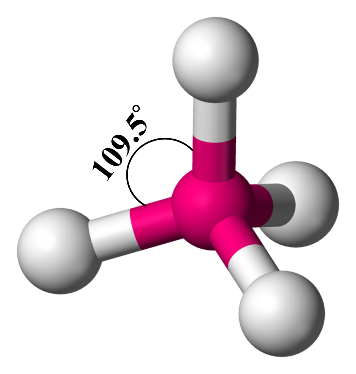
3- رباعيّ الأوجه منتظم Tetrahedral
إذا وُجدت أربعةُ أزواج منَ الإلكترونات الرابطة حولَ الذرّة المركزيّة فإنّها تترتّبُ باتّجاه زوايا رؤوس رباعيّ الأوجه منتظمTetrahedral ، وتكونُ الزاويةُ بين الروابط (109.5˚)
أمثلة: (CH4) ، (CCl4) ، (CBr4)
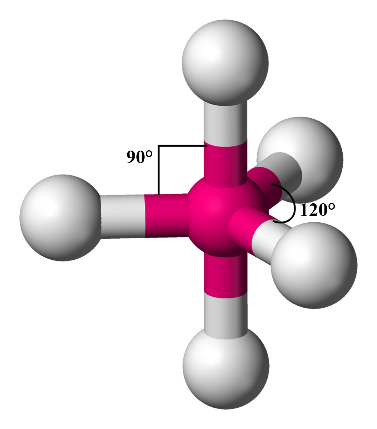
4- هرم ثنائيّ مثلّث Bipyramidal
وفي حال وجود خمسة أزواج منَ الإلكترونات الرابطة حولَ الذرّة المركزيّة فإنّها تتوزّعُ باتّجاه رؤوس هرم ثنائيّ مثلّث Bipyramidal، وتكونُ الزاوية بين الروابط (120˚, 90˚)
أمثلة: (IF5) ، (ICl5)
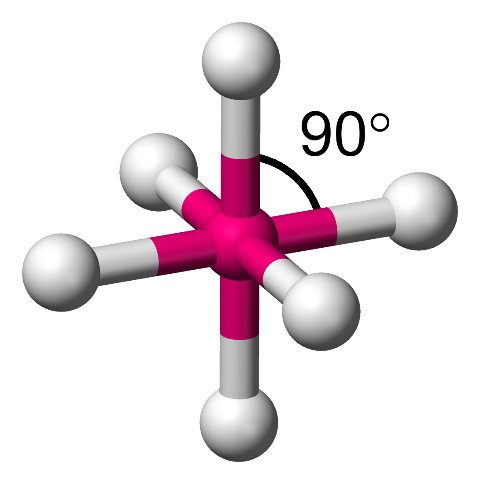
5- ثمانيّ السطوح Octahedral
وإذا أُحيطت الذرّةُ المركزيّة بستة أزواج منَ الإلكترونات الرابطة فإنّها تتوزّعُ باتَجاه رؤوس ثمانيّ السطوح Octahedral ، وتكون الزاوية بين الروابط (90˚)
أمثلة: (SF6) ، (SCl6)
فماذا لو ارتبطت الذرّاتُ بروابطَ ثنائيّةٍ أو ثلاثيّة، فهل يختلفُ الشكلُ الفراغيُّ للجزيء؟ وهل يختلفُ مقدارُ الزاوية بين الروابط إذا امتلكتِ الذرّةُ المركزية أزواجَ إلكترونات غيرِ رابطة؟
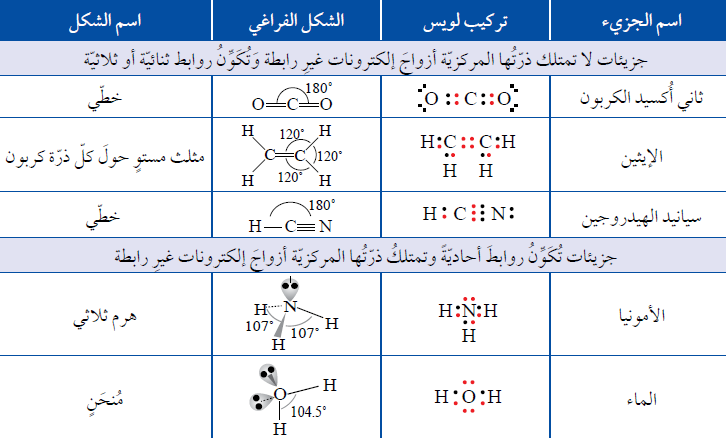
* تمتلكُ الذرّاتُ المركزيّة في بعض الجزيئات أزواجًا منَ الإلكترونات غيرِ الرابطة، تتنافرُ بقوّة أكبرَ من تنافر أزواج الإلكترونات الرابطة، فتكون الزاويةُ بينها أكبرُ منَ الزاوية بين أزواج الإلكترونات الرابطة، ويمكنُ ملاحظة ذلك في كلٍّ من جزيئات الأمونيا وجزيئات الماء.
1- هَرَمًا ثلاثيًّا Pyramidal
عند وجود ثلاث أزواج منَ الإلكترونات الرابطة وزوج من الإلكترونات غير الرابطة فإن الشكل الفراغي المتكون هو هرمًا ثلاثيًا. وتكونُ الزاوية (107˚)
أمثلة: (NH3) ، (NCl3) ، (NBr3)
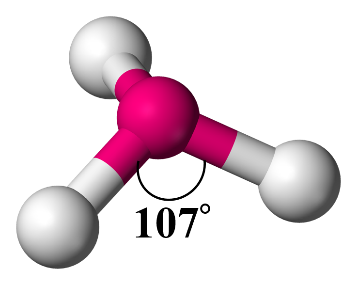
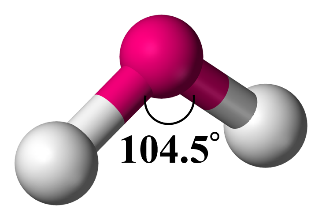
2- مُنحنيًا Bent
عند وجود زوجين منَ الإلكترونات الرابطة وزوجين من الإلكترونات غير الرابطة فإن الشكل الفراغي المتكون هو منحنيًا. وتكونُ الزاوية (104.5˚)
أمثلة: (H2O) ، (H2S)
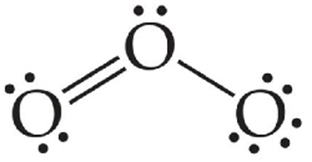
افكر: يحقّقُ الأُكسجينُ في مركّباته قاعدةَ الثمانية، فما الشكلُ المتوقع لجزيء الأوزون O3 وكيف تترتّبُ أزواج الإلكترونات حولَ الذرّة المركزيّة؟
أتحقَّق: قارن بين الجزيئات الآتية من حيثُ الشكلُ الفراغيُّ ومقدارُ الزاوية بين الروابط:
C2H6 , BF3 , NCl3
NCl3 الشكل الفراغي: هرمي ثلاثي بزاوية 107°
BF3 الشكل الفراغي: مثلث مستوّ بزاوية °120
C2H6 الشكل الفراغي: رباعي الأوجه منتظم بزاوية °109.5