هاليدات الألكيل:
الهالو ألكانات (R-X) : هي مُركّبات هيدروكربونية حَلّت فيها ذرة هالوجين أو أكثر محلّ ذرة أو ذرات هيدروجين، وصيغتُها العامَةُ R-X ، حيث تُمثَّل R مجموعة ألكيل، أمّا X فتُمثَّل إحدى ذرات الهالوجينات التي هي عناصر المجموعة السابعة F, Cl, Br ,I .
تسمية هاليدات الألكيل وفق نظام تسمية الأيوباك:
ينظر للمُركّب على أنه مُكوّن من جزئين أحدهم ا يُمثَّل الهالوجين، ويُسمّى هاليدا، أمّا الجزءُ الآخر فيُمثَّل مجموعة الألكيل R مثل )الميثيل، الإيثيل، بروبيل ... ،)
يعامَلُ الهالوجين بوصفه تفرُّعا على سلسلة الألكان، ويكون الاسم العام لها هالو ألكانات.
Br: برومو
F: فلورو
I: ايودو
Cl: كلورو
- خطوات تسمية هاليدات الألكيل :
1- نرقم ذرات الكربون في أطول سلسلة من الطرف الأقرب إلى تفرع الهاليد.
2- نكتب رقم ذرة الكربون التي تحمل ذرة الهالوجين ، تليه شرطة، ثم سم الهالوجين على وزن هالو ثم اسم الألكان.
3- في حال وجود أكثر من ذرة هالوجين متماثلة نعطي كل منها رقم يمثل ذرة الكربون التي ترتبط به ا ذرات الهالوجين و نضع فاصلة بين كل رقم وآخر.
4- نستخدم كلمة (ثنائي، ثلاثي) للدلالة على عدد ذرات الهالوجين المتماثلة في المركب.
الخصائص الفيزيائية لهاليدات الألكيل:
هاليدات الألكيل مركبات قطبية نظراً لاختلاف لارتفاع السالبية الكهربائية لمعظم الهالوجينات، لذا تترابط جز يئاتها بقوى ثنائية القطب.
- درجات الغليان :
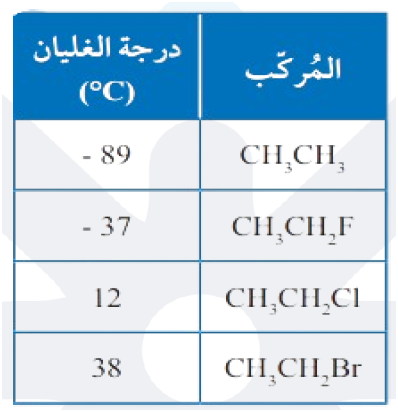
درجات غليان هاليدات الألكيل أعلى من الهيدروكربونات المقاربة لها في الكتلة المولية، كما أن درجات غليانها تزداد بزيادة الكتلة المولية للهالوجين إذا ارتبطوا بعدد مماثل من ذرات الكربون.
لاحظ اختلاف درجات غليان الإيثان مقار نة بهاليدات الألكيل المقابلة لها:
- الحالة الفيزيائية:
تتواجد معظم هاليدات الألكيل في الحالة السائلة أو الصلبة في درجة الحرارة العادية.
- الذائبية في الماء:
رغم كون هاليدات الألكيل قطبية إلا أنها لا تذوب في الماء؛ لأن قوى ثنائية القطب التي تنشأ بين هاليدات الألكيل والماء ضعيفة لا تستطيع التغلب على الروابط الهيدروجينية بين جزيئيات الماء.
الأهمية الصناعية لهاليدات الألكيل :
تستخدم هاليدات الألكيل مباشرة في الصناعة، أو كمادة أولية لتحضير مركبات أخر ى .
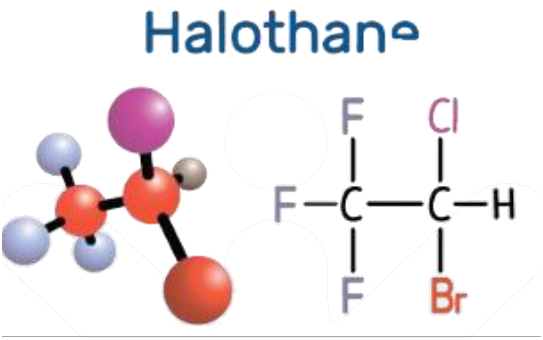
- استخدم الكلوروفورم قديماً كمادة مخدرة في العمليات الجراحية ، وبسبب آثاره الجانبية حل محله هاليد ألكيل آخر سمي الهالوثان.
- تستخدم ﻫﺎﻟﻴﺪات اﻷﻟﻜﻴﻞ ﻛﻤﺬﻳﺒﺎت ﻋﻀﻮﻳﺔ، ﻣﺜﻞ ﺛﻼﺛﻲ ﻛﻠﻮرو إﻳﺜﻴﻦ C2HC13 اﻟﺬي ﻳﺴﺘﺨﺪم ﻓﻲ اﻟﺼﻨﺎﻋﺎت اﻹﻟﻜﺘﺮوﻧﻴﺔ.
- اﺳﺘﺨﺪم ﺛﻼﺛﻲ ﻛﻠﻮرو ﻓﻠﻮرو ﻣﻴﺜﺎنCCl3F ﻛﻤﺎدة ﻧﻔﺦ ﻓﻲ ﺻﻨﺎﻋﺔ اﻟﺒﻼﺳﺘﻴﻚ اﻟﺮﻏﻮي (الفوم).
- ﻳﺴﺘﺨﺪم ﻛﻠﻮرو إﻳﺜﻴﻦ ﻓﻲ ﺻﻨﺎﻋﺔ أﻛﺜﺮ أﻧﻮاع اﻟﺒﻼﺳﺘﻴﻚ اﺳﺘﺨﺪاﻣﺎً، ﺣﻴﺚ ﻳﺴﺘﺨﺪم ﻓﻲ ﺗﻤﺪﻳﺪات ﺷﺒﻜﺎت اﻟﻤﻴﺎه واﻟﺼﺮف اﻟﺼﺤﺮي.
- ﺗﺴﺘﺨﺪم ﺑﻌﺾ اﻟﻤﺮﻛﺒﺎت اﻟﻬﻴﺪروﻓﻮروﻛﺮﺑﻮﻧﻴﺔ ﻛﻐﺎزات ﻣﺒﺮدة ﻓﻲ اﻟﺜﻼﺟﺎت وأﺟﻬﺰة اﻟﺘﺒﺮﻳﺪ
اﻟﺮﺑﻂُ ﺑﺎﻟﺒﻴﺌﺔ:
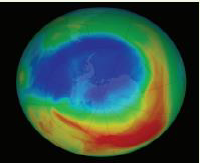
أدّى اﻻﺳﺘﺨﺪام اﻟﻮاﺳﻊ ﻟﻠﻤُ ﺮﻛّﺒﺎت اﻟﻜﻠﻮروﻓﻠﻮروﻛﺮﺑﻮﻧﻴﺔ CFCs، ﻣﺜﻞ CCl2F2، إﻟﻰ اﻹﺿﺮار ﺑﻄﺒﻘﺔ اﻷوزون؛ ﻷﻧﻬﺎ ﺗﺘﺤﻠّﻞ ﺑﻔﻌﻞ اﻷﺷﻌﺔ ﻓﻮق اﻟﺒﻨﻔﺴﺠﻴﺔ ﻣُ ﺤﺮّرةً ذرّة ﻛﻠﻮر ﻣﻨﻔﺮدة ﺗﺘﻔﺎﻋﻞُ ﻣﻊ اﻷوزون وﺗُﻔﻜّﻜﻪ، وﻳﻤﻜﻦ أن ﺗﺴﺒّﺐ ذرّة ﻛﻠﻮر واﺣﺪة ﺗﻔﻜﱡﻚ ﻣﺌﺎت اﻵﻻف ﻣﻦ ﺟﺰﻳﺌﺎت اﻷوزون.
وﻗﺪ ﺣﻠّﺖ اﻟﻤُ ﺮﻛّﺒﺎت اﻟﻬﻴﺪروﻓﻠﻮروﻛﺮﺑﻮﻧﻴﺔ HFCs ، وﻣﻨﻬﺎ CF3CH2F ﻣﺤﻠّﻬﺎ. ﺗُﻈﻬﺮ اﻟﺼﻮر اﻟﻤﻠﺘﻘﻄﺔ ﺗﺤﺴﱡﻨًﺎ واﺿﺤً ﺎ ﻋﻠﻰ ﻃﺒﻘﺔ اﻷوزون وﻋﻠﻰ ﺻﻐﺮ ﺣﺠﻢ ﺛﻘﺐ اﻷوزون ﺣﺴﺐ وﻛﺎﻟﺔ ﻧﺎﺳﺎ اﻟﻔﻀﺎﺋﻴﺔ
الكحولات:
ﻫﻲ اﻟﻤﺮﻛﺒﺎت اﻟﻌﻀﻮﻳﺔ اﻟﺘﻲ ﺗﺤﺘﻮي إﺿﺎﻓﺔ إﻟﻰ اﻟﻜﺮﺑﻮن و اﻟﻬﻴﺪروﺟﻴﻦ ﻋﻠﻰ اﻟﻤﺠﻤﻮﻋﺔ اﻟﻮﻇﻴﻔﻴﺔ (OH) اﻟﺘﻲ ﺗﺴﻤﻰ ﻣﺠﻤﻮﻋﺔ اﻟﻬﻴﺪر وﻛﺴﻴﻞ ، وﺗﺮﺗﺒﻂ ﺑﺎﻟﺠﺰء اﻟﻬﻴﺪروﻛﺮﺑﻮﻧﻲ ﻣﻦ اﻷﻟﻜﺎن (R) (ﻣﺠﻤﻮﻋﺔ اﻷﻟﻜﻴﻞ) وﻳﺸﺘﻖ اﻟﻜﺤﻮل ﻣﻦ اﻷﻟﻜﺎن ﻧﺘﻴﺠﺔ اﺳﺘﺒﺪال ﻣﺠﻤﻮﻋﺔ اﻟﻬﻴﺪروﻛﺴﻴﻞ ﺑﺬرة ﻫﻴﺪروﺟﻴﻦ ﺗُﻌﺮّ ُف اﻟﻜﺤﻮﻻت ﺑﺄﻧﻬﺎ ﻣُ ﺮﻛّﺒﺎت ﻋﻀﻮﻳﺔ ﺻﻴﻐﺘﻬﺎ اﻟﻌﺎﻣﺔ OH، ﺣﻴﺚ ﺗُﻤﺜﱠﻞ ﻣﺠﻤﻮﻋﺔ اﻟﻬﻴﺪر وﻛﺴﻴﻞ – OH اﻟﻤﺠﻤﻮﻋﺔ اﻟﻮﻇﻴﻔﻴﺔ اﻟﻤﻤﻴﺰة ﻟﻬﺎ وﺗُﻤﺜﱠﻞ R ﻣﺠﻤﻮﻋﺔ أﻟﻜﻴﻞ.
مميزات الكحولات : -
1 تعد مركبات عضوية مشبعة -
2 الصيغة العامة لها - R-O-H
3 تسمى OH ب مجموعة الهيدروكسيل
4 - R هي مجموعة الألكيل
5 أبسط الكحولات الميثانول