مركبات الكر بونيل والحموض الكربوكسيلية ومشتقاتها
• الألدهيدات Aldehydes :
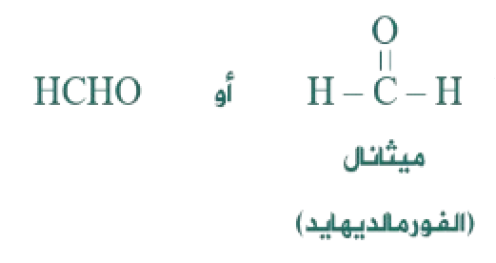
الألديهايدات: مركبات عضوية غير مشبعة تحتوي على مجموعة كربونيل كمجموعة وظيفية، وتمتاز بوجود ذرة هيدروجين طرفية مرتبطة بمجموعة الكربونيل، وتحمل الصيغة العامة:
حيث R: مجموعة ألكيل أو ذرة هيدروجين.
تحمل الألديهايدات الصيغة الجزيئية العامة:
n= 1-2-3………
يحتوي أبسط الألديهايدات على ذرة كربون واحدة ويسمى الميثانال ويعرف باسمه الشائع (الفورمالديهايد).
توجد الألديهايدات في بعض المواد الغذائية كاللوز والقرفة، وهي التي تعطيهما النكهة المميزة.
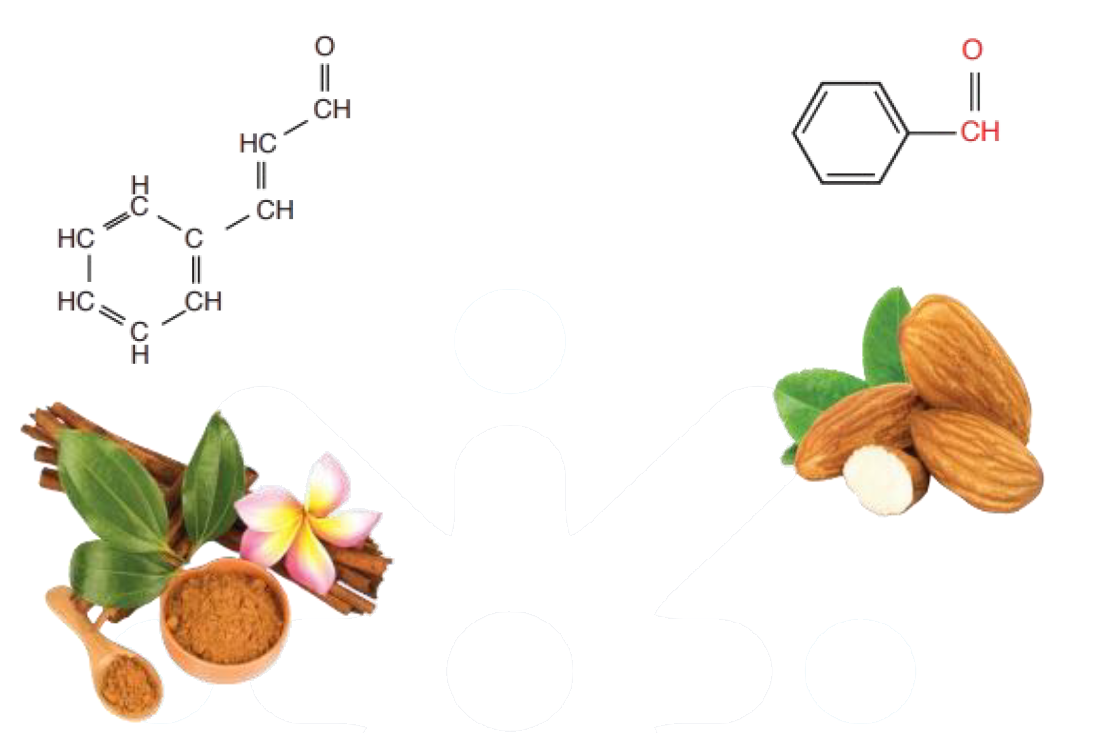
النكهات المميزة للقرفة، واللوز، لاحتوائها على مركبات تنتمي للألديهايدات.
- قواعد التسمية النظامية للألديهايدات:
1. أحسب عدد ذرات الكربون في الألديهايد ومن ضمنها ذرة كربون مجموعة الكربونيل.
2. أسمي الألديهايد حسب عدد ذرات الكربون على وزن ألكانال.
3. إذا احتوى الألديهايد على تفرع فأرقم السلسلة من ذرة كربون مجموعة الكربونيل وأسمي التفرعات أولاً.
مثال:-
أُسمّي المُركّب الآتي:-
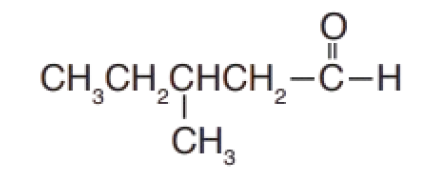
الحلُّ:
أحدّد أطول سلسلة كربونيّة تتضمّن مجموعة الكربونيل الوظيفية وأُرقّمها
بدءًا من مجموعة الكربونيل؛ أي أنها تأخذ الرقم 1 دائمًا؛ لذا لا يُشار إلى الرقم عند كتابة الاسم، وأحدّد المجموعات الفرعية أيضاً.
ألاحظُ أن أطول سلسلة كربونيّة تتضمّن مجموعة الكربونيل مُكوَّنة من 5 ذرات كربون، فتسمى بنتانال، وأن مجموعة الميثيل مُرتبطة بذرّةالكربون رقم 3.
فيكون اسم المركب: 3 -ميثيل بنتانال.
الكيتونات Ketones :
الكيتونات: مركبات عضوية غير مشبعة تحتوي على مجموعة كربونيل كمجموعة وظيفية، وتقع مجموعة الكربونيل بي ن مجموعتي ألكيل (R) على جانبيها، وتحمل الصيغة العامة:
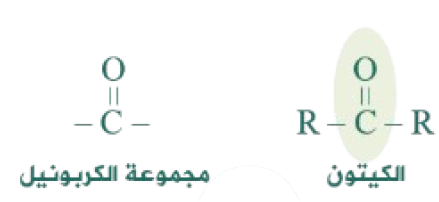
تحمل الكيتونات الصيغة الجزيئية العامة:
n=3,4,5…..
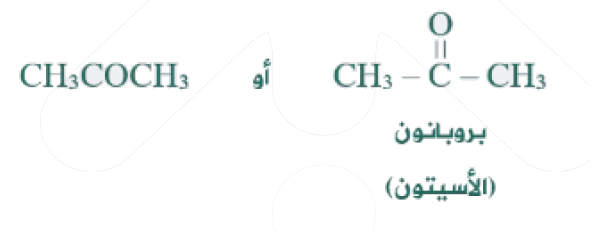
يحتوي أبسط الكيتونات على (3) ذرات كربون ويسمى بروبانون، واسمه الشائع (أسيتون)، ويستخد م في إزالة الطلاء عن الأظافر.
- قواعد التسمية النظامية للكيتونات :
1 . أحسب عدد ذرات الكربون في الكيتون وم ن ضمنه ا ذرة كربون مجموعة الكربونيل.
2 . أسمي الكيتون حسب عدد ذرات الكربون على وزن الكانون .
3 . إذا زاد عدد ذرات الكربون في الكيتون عن (4)ذرات فاسبق اسم الكيتون بموقع مجموعة الكربونيل بعد ترقيم السلسلة م ن الطر ف الأقرب لمجموعة الكربونيل.
4 . إذا احتوى الكيتون على تفرع فيجب ترقيم أطول سلسلة م ن الطرف الأقرب لمجموعة الكربونيل ثم تسمية التفرع برقمه ثم ضع موقع مجموعة الكربونيل ثم اسم السلسلة الطويلة على وزن ألكانون.
• الخصائص الفيزيائية للألدهيدات والكيتونات:
الألدهيدات والكيتونات مركبات قطبية بسبب قطبية رابطة مجموعة الكربونيل، وعليه فهي تترابط بقوى ثنائية القطب والتي تعتمد على الكتلة المولية.
- درجات الغليان:
درجة غليان الألديهايدات والكيتونات أعلى من درجات غليان الألكانات المقاربة لها في الكتلة المولية، لترابط جزيئاتها بقوى ثنائية القطب الأقو ى من قوى لندن بين جزيئات الألكانات، ولكن درجات غليانها أقل م ن الكحولات، وتزداد درجة غليان الألديهايد أو الكيتون بزيادة كتلته المولية.
- الذائبية في الماء :
تذوب الألديهايدات والكيتونات في الماء نظراً لإمكانية تكوين الألديهايد والكيتون روابط هيدروجينية مع الماء، ولكن ذائبيته تقل بزيادة الكتلة المولية له. تذوب الألديهايدات والكيتونات في المذيبات العضوية؛ لذا فهي تستخدم كمذيبات عضوية.
بعض استخدمات الألديهيدات والكيتونات

الحموض الكربوكسيلية Carboxylic acids:
الحموض الكربوكسيلية: مركبات عضوية غير مشبعة تحتوي على مجموعة كربوكسيل (COOH) كمجموعة وظيفية، وتحمل الصيغة العامة:
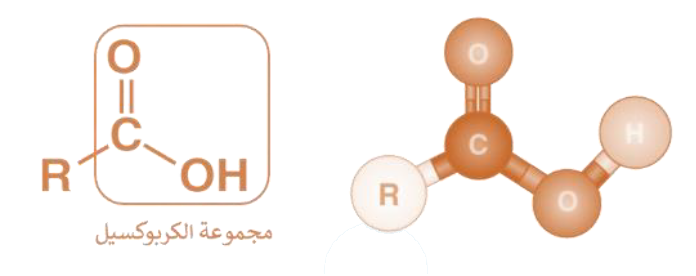
يمكن أن تكون R ذرة هيدروجين.
تحمل الحموض الكربوكسيلية الصيغة الجزيئية العامة:
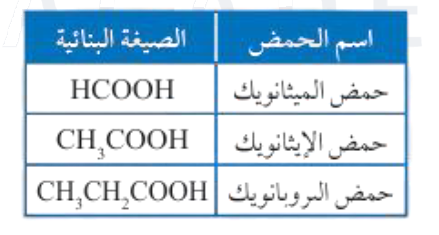
تسمية الحموض الكربوكسيلية:
1. أكتب كلمة حمض .
2 . أحسب عدد ذرات الكربون في المركب ومن ضمنها ذرة كربون مجموعة الكربوكسيل.
3 . أسمي المركب على وزن الكانويك.
4. إذا احتوى الحمض الكربوكسيلي على تفرع فيسمى أولاً وقبل كلمة حمض بعد ترقيم.
الخصائص الفيزيائية للحموض الكربوكسيلية:
أولاً: الترابط الهيدروجيني ودرجة الغليان
تترابط جزيئات الحموض الكربوكسيلية بروابط هيدروجينية، ويعزى سبب تكوين الحموض الكربوكسيلية لروابط هيدروجينية بين جز يئاتها إلى احتوائها على الرابطة القطبية (O-H)، مما يؤدي إلى حدوث تجاذب بين ذرة الهيدروجين في جزيء حمض كربوكسيلي وذرة أكسجين في جزيء حمض كربوكسيلي آخر، وفي الواقع فإن تعدد الروابط الهيدروجينية في الحمض الكربوكسيلي يتسبب في زيادة قوى التجاذب بين جزيئاتها وبالتالي ارتفاع درجة غليانها، حتى أن درجة غليانها أعلى من الكحولات.
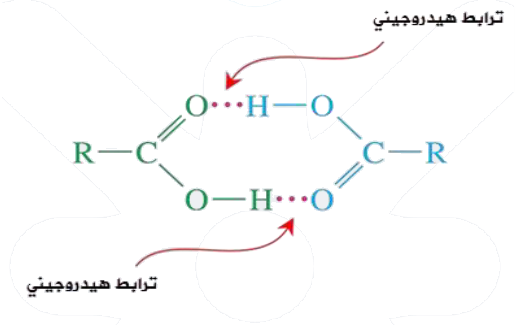
يعتمد الترابط الهيدروجيني على عاملين هما:
1. عدد الروابط الهيدروجينية (طردي).
2. الكتلة المولية (طردي).
ثانياً: الذائبية في الماء:
الحموض الكربوكسيلية التي تحتوي على عدد قليل من ذرات الكربون تذوب في الماء بأية نسبة نظراً لقدرتها على تكوين روابط هيدروجينية مع الماء، وبزيادة عدد ذرات الكربون تقل الذائبية، نظراً لأن المركب يقترب من خواص الألكانات.
الإسترات Esters :
الإسترات: مركبات عضوية غير مشبعة، وتحمل الصيغة العامة:
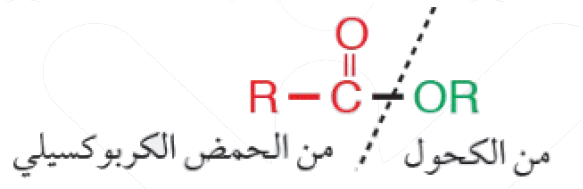
(يمكن أن تكون R ذرة هيدروجين).
وتشتق الإسترات من تفاعل الكحول مع الحمض الكربوكسيلي.
تحمل الإسترات الصيغة الجزيئية العامة:
لاحظ أن الصيغة الجزيئية للإسترات مشابهة للصيغة الجزيئية للحموض الكربوكسيلية، فهما بذلك متصاوغات وظيفية.
تتميز الإسترات برائحة عطرة تشبه رائحة بعض أنواع الفواكه، إلا أن هذا لا يعني بالضرورة وجود هذه الإسترات في الفواكه .
قواعد التسمية النظامية للإسترات:
1 . أسمي الجزء المشتق من الحمض الكربوكسيلي على وزن الكانوات.
2 . أسمي الجزء المشتق من الكحول على وزن ألكيل.
الخواص الفيزيائية للإسترات:
الإسترات مركبات قطبية، وعليه فجزيئاتها تترابط بقوى ثنائية القطب التي تعتم د على الكتلة المولية.