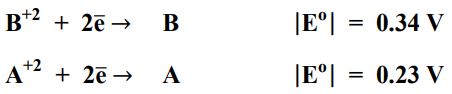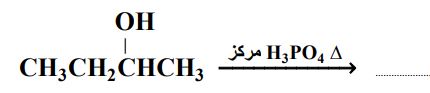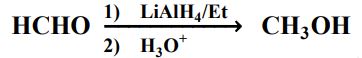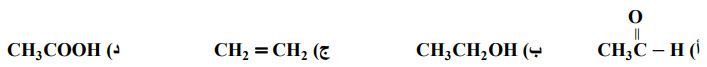امتحان نهائي للفصلين - استاذ نضال الهندي
امتحان نهائي للفصلين - استاذ نضال الهندي
عدد الاسئلة : 65 أسئلة
امتحان نهائي للفصلين - استاذ نضال الهندي
00 : 00 دقيقة
1) المادة التي تتأين في الماء وتنتج أيونات OH-
2) الحمض المرافق HCO3- والقاعدة المرافقة HPO42- ناتج من تفاعل
أ) CO32- و H2PO4- ب) H2CO3 و H2PO4- ج) CO3 و H2PO4- د) H2CO3و PO43-
3) أحد الأيونات التالية يعتبر امفوتيري:
أ) C254-2 ب) HPO4-2 ج) HCOO- د) C3H7COO-
4) في التفاعل الآتي Cu+2 + 6NH3 [Cu(NH3]+2 فإن
أ) Cu حمض لويس / NH3 قاعدة لويس ب) 2+Cu حمض لويس / NH3 قاعدة لويس
ج) Cu+2 حمض لويس / N قاعدة لويس د) Cu حمض لويس / N قاعدة لويس
5) إذا علمت أن pH لمحلول KOH = 13 ، فإن كتلة KOH المذابة في (mL 500) من المحلول =) Mr KOH = 56g/mol) :
6) إذا علمت ان محلول القاعدة NaOH رقمه الهيدروكسيلي POH يساوي (0) فإن احد الجمل التالية صحيحة :
أ) تركيز H3O+ يساوي 1M ب) تركيز Na+ يساوي 1M
ج) تركيز OH- يساوي 1 × 10-14 د) PH تساوي 13
7) يتعادل ml 50 مع الحمض HCI الذي تركيزه M 0.02 مع 20 ml من محلول القاعدة NaOH فإن كتلة NaOH الذائبة في المحلول (بالغرام) (g/mol 40 = NaOH (Mr
8) يتأين الكاشف الحمضي HIn حسب المعادلة (H3O+ + In- HIn + H2O) وعند إضافة هذا الكاشف لمحلول قاعدي فإنه: لون(1) لون(2)
أ) يسود في المحلول اللون (2) ب( يسود في المحلول اللون (1)
ج) يقل تركيز -In د) يزداد تركيز HIn
** المعادلات الآتية تمثل تفاعلات لمحاليل الحموض ((HF, CN, HO المتساوية التركيز
إذا كان الاتزان في التفاعلات السابقة يرجح الاتجاه الأمامي (): أجب عن الأسئلة من (13 - 9)
9) ما صيغة القاعدة المرافقة الأقوى :
أHSO3- ( ب) F- ج) CN- د) HCN
10) ما صيغة الحمض الذي له أعلى Ka:
أ) H2SO3 ب) HF ج) HCN د) HSO-3
11) أي المحلولين HF أم HCN يكون فيه [ OH-] هو الأقل:
12) أي الحموض له أعلى pH:
أ) CN- ب) H2SO3 ج) HF د) HCN
13) أي الحموض المذكورة أكثر تأيناً في الماء:
أ) HF ب) H2SO3 ج) HCN د) HSO3-
14) قيمة Ka للحمض الضعيف HX (تركيزه 0.2 ) و pH له تساوي (3.7) : (0.3 = 2 log)
أ) -410 × 4 ب) -410 × 2 ج) -710 × 4 د) -710 × 2
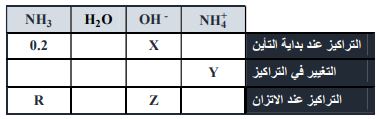
* ادرس الجدول أدناه المتعلق بتأين الأمونيا في الماء وفق المعادلة الآتية: NH3 + H2O OH- +NH4+ثم أجب عن الفقرتين (16 , 15)
(15 مقدار التغير في التركيز الذي تمثله القيمة (Y) يساوي:
أ) +X ب) -X ج) 0.2 د) 0.2 – X
16) عند الاتزان فإن القيمة المشار إليها بالرمز (R) هي:
أ) 0.2 – X ب) X - 0.2 ج) X + د) X -
17) بعض الاملاح تذوب في الماء وتتفكك الى أيونات موجبة وأخرى سالبة وتنتشر بين جزيئات الماء دون أن تتفاعل معها وهذا ينطبق على محلول الملح القادم من تفاعل :
أ) KOH و HclO ب) HI و NaOH ج) KOH و HNO2 د) HBr و NH
18) إذا علمت أن ترتيب الاملاح (iLiF , LiCN , HCOOL) وفق تميهها هو LiCN > HCOOLi > LiF
فإي العبارات الآتية الصحيحة :
أ) الحمض HCN له أعلى Ka ب( القاعدة -HCOO هي الأقوى
ج) ترتيب الحموض حسب PH تصاعدياً HF > HCOOH > HCN
د) ترتيب الحموض حسب قوتها HF > HCOOH > HCN
19) لديك محلول الملح PH, CH3NH3CI له تساوي 4 ومحلول الملح PH, NH4CIله تساوي 3 اعتمادا على ذلك حدد الجملة الصحيحة
أ) تميه CH3NH3CI1 > تميه NH4C1
ب) Kb للقاعدة Kb < NH3 للقاعدة CH3NH2
ج) [H3O+] للقاعدة NH3 > [H3O+] للقاعدة 2 CH3NH
د) [ OH-] للملح OH- ] < NH4CI] للملح CH3NH3CI
20) عند إضافة بلورات من NaOCN الى محلول HOCN
أ) POH المحلول تقل ب) CN- يصبح أيون مشترك
ج( المحلول الناتج يصلح أن يصبح محلول منظم قاعدي د) تأين HOCN يزداد
21) الأيون المشترك في المحلول المكون من القاعدة M والملح MHCI هو:
أ) M- ب) MH ج) MCI د) MH+
22) محلول مكون من القاعدة (B) والملح (BHCI) بتركيز M 0.1 لكل منها و pH للمحلول = 8، فإن Kb للقاعدة (B) يساوي:
أ) (6-10 × 1) ب) (8-10 × 1) ج) (8-10 × 2.5) د) (8-10 × 2.5)
** محلول منظم حجمه ml 100 يتكون من HCOOH تركيزه M 0.4 والملح HCOONa تركيزه 0. 2 M PH هذا المحلول 4.7 اعتمادا على ذلك ، اجب عن الفقرات (23 و 24) (0.3 = log2)
(23) قيمة Ka للحمض
أ) (5-10 × 2) ب) (5-10 × 1) ج) (-410 × 1) د) (-410 × 2)
24) ما عدد مولات NaOH المضافة الى هذا المحلول لتصبح PH المحلول (5)
أ) 0.1 ب) 0.02 ج) 0.01 د0.001 (
**التفاعل الكيميائي الذي يتضمن رموزا افتراضية للفلز X واللافلز Y وعنصر الهيدروجين , اجب عن الفقرات (25 و 26 و 27)
2X +3H2Y X2Y2 + 3H2
(25) مقدار التغير في عدد التأكسد Y
26) عدد تأكسد X في X,Y
27) العامل المؤكسد
ا) X ب) H2Y ج) X2Y3 د) H2
28 عدد تأكسد الاكسجين يساوي (1-) في
أ) O3 ب) CaO2 ج) MgO د)OF2
29) المادة التي تعتبر عامل مختزل
أKMnO4 ( بK2Cr2O7 ( ج) F2 د) CO
30) عدد مولات الالكترونات اللازمة لموازنة نصف التفاعل الآتي في وسط حمضي NO3- → N2H4
31) في خلية جلفانية مكونة من قطبي الرصاص Pb والكروم Cr لوحظ بعد مرور زمن من عمل الخلية الجلفانية أن تركيز أيونات +Cr3 في الوعاء يزداد اعتمادا على ذلك فإن احد الجمل التالية صحيحة
أ) العامل المؤكسد هو Cr3+ والعامل المختزل هو Pb
ب( تتجه الأيونات السالبة من القنطرة الملحية الى وعاء القطب Cr
ج( المهبط هو Pb وإشارته سالبة
د) نصف التفاعل الحادث عند المصعد Pb → Pb2+ + 2e-
32) يحدث التفاعل التالي Sn2+ + Ni Ni2+ + Sn في خلية جلفانية فإن الوصف المختصر لخلية جلفانية هو
33) عند حدوث اختلال في الاتزان الكهربائي في كل من نصفي الخلية الجلفانية، فإن المسؤول عن إعادة الاتزان الكهربائي هو:
أ) جهاز الفولتميتر ب) المصعد ج) القنطرة الملحية د) المهبط
34) عند وضع سلك من الخارصين في محلول من HCI المخفف يتصاعد غاز الهيدروجين، لكن عند وضع سلك من النحاس لم يتصاعد غاز الهيدروجين، فعند عمل خلية جلفانية من قطبي الخارصين والنحاس، أي من العبارات التالية صحيحة:
أ) الخارصين هو القطب الموجب ب) تزداد كتلة قطب الخارصين
ج) تسري الإلكترونات من قطب النحاس إلى قطب الخارصين د) يحدث اختزال لأيونات النحاس
35) اعتماداً على المعلومات الآتية للفلزات D / C / B / A:
1 - يتفاعل C فقط مع محلول حمض HCI (1M)، ويتصاعد غازH2
2- عند وضع سلك من الفلز A في محاليل أيونات الفلزات الأخرى يتكون الفلز D ولا يتكون الفلز BأوC فإن ترتيب الفلزات الأربعة (A , B , C , D ( تنازلياً وفق قوتها كعوامل مختزلة:
أ) D < A< C < B ب A < D < B < C (
ج) A < B < D < C د) D < A < B < C
36) أي مما يلي يعد من خواص المهبط في الخلية الجلفانية:
أ) تقل كتلته أثناء التفاعل الكيميائي ب) المكان الذي يحدث عنده التأكسد
ج) اتجاه انحراف مؤشر الفولتميتر نحوه د) تذوب ذراته في المحلول
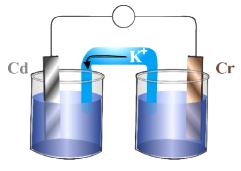
37) الشكل الآتي يمثل خلية جلفانية، فأي العبارات التالية تعتبر غير صحيحة:
أ) تتحرك ē من قطب Cr إلى قطب Cd ب( تزداد كتلة صفيحة Cd
ج) ينحرف مؤشر الفولتميتر نحو قطب Cd د) يزداد تركيز Cd+2 في نصف خلية Cd
38) إذا علمت أن القيم المطلقة لجهود الاختزال المعياري للعنصرين A و B كما يلي:
وقد لوحظ عند وصل نصف الخلية A مع نصف الخلية B أن الإلكترونات تنقل من AإلىB، كما لوحظ عند وصل نصف الخليةA مع قطب الهيدروجين أن الإلكترونات تنقل من قطب A إلى قطب الهيدروجين.. فإن °E للخلية الجلفانية المكونة من A و B = ( بالفولت ) :
أ+ 0.57( ب)0.57 - ج) 0.11 - د+ 0.11(
39) إذا علمت أن °E للتفاعل 2A1+3 + 3Cu 2Al + 3Cu+2 يساوي (2) فولت فإن °E للتفاعل الآتي: 4Al + 6Cu+2 4A1+3 + 6Cu يساوي (بالفولت):
40) خلية جلفانية قطباها (Ni /Pb) واتجاه انحراف مؤشر الفولتميتر نحو القطب الرصاص (Pb)
فإن التفاعل الكلي للخلية هو :
أ) Ni+2 + Pb → Ni + Pb+2 ب) Ni → Ni+2
ج) Pb →Pb+2 د) → Ni + Pb+2 Ni+2 + Pb
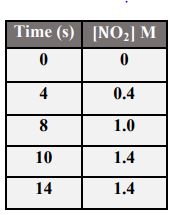
41- البيانات الواردة في الجدول المجاور تخص التفاعل الآتي:
2N2O5(g) → 4NO2(g) + O2(g) فإن سرعة استهلاك N2O5 في الفترة الزمنية 8 إلى 12 تساوي بوحدة 1-M.s:
42- أي التفاعلات الآتية يعتبر تفاعلاً سريعاً:
أ) تفاعلات محاليل الحموض والقواعد. ب) تفاعل تكون صدأ الحديد.
ج) تكون النفط. د) تكون الفحم الحجري.
43- المماس الذي يتم رسمه بالمسطرة في الشكل المجاور، يمكن استخدامه لإيجاد السرعة:
أ) المتوسطة ب) اللحظية.
ج) الابتدائية. د) سرعة اختفاء المادة المتفاعلة.
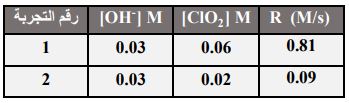
44- تم جمع البيانات للتفاعل ثلاثي الرتبة الآتي: 2CIO2 + 2OH- CIO-2 + H2Oفإن قانون سرعة التفاعل هو:
أ R = k [CIO2]1. [OH-]2 ( بR = k [CIO2]2. [OH-]1 (
ج) 3[R = k [CIO2 د) 3[ R = k [OH-
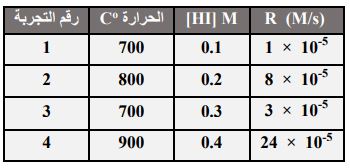
45- الجدول الآتي يمثل تفكك غاز HI، فإن قانون سرعة التفاعل هو:
أ) R = k ب) 1[R = k [HI
ج) 2[R = k [HI د) 3[R = k [HI
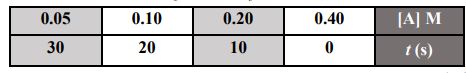
64- تم قياس تركيز مادة متفاعلة A بشكل دوري وتسجيله في الجدول الآتي:
فأن قانون سر عة التفاعل:
أ) R = k بR = k [A]1 ( ج) 2[R = k [A د) 3[R = k [A
47- التفاعل الافتراضي: 2XY + 60 KJ X2 + Y2، يحدث عند درجة حرارة معينة، إذا علمت أن إذا علمت أن HP تساوي أربعة أضعاف HR ، وأن طاقة المعقد المنشط عشرة أضعاف H متفاعلات... فإن Ea1 و Ea2 على الترتيب (بالكيلوجول) تساوي
أ(120, 180) ( ب(180, 120) ( ج) (120,60) د) (60 , 120)
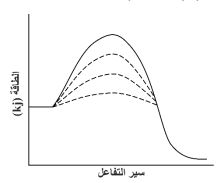
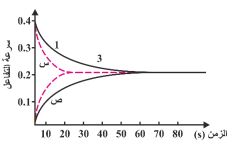
84- الشكل المجاور يمثل منحنيات الطاقة لتفاعل معين بوجود ثلاثة عوامل مساعدة وكانت طاقة التنشيط المقاسة كما يلي: 105 / 55 / 75 /90) kj، فإن قيمة طاقة التنشيط بدون عامل مساعد تساوي (kj):
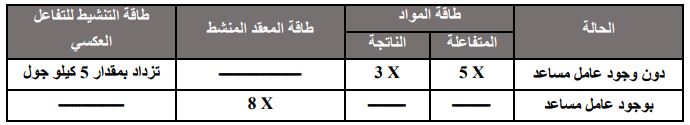
** يبين الجدول أدناه بعض قيم الطاقة (كيلو) جول) للتفاعل 2AB + 40 KJ A2 + B2 عند درجة حرارة معينة، أدرسه ثم أجب عن الأسئلة (49 , 50 , 51 ):
49 - قيمة طاقة المعقد المنشط بدون وجود العامل المساعد (كيلو جول) تساوي: ب) 165
أ) 160 ب) 165 ج) 80 د) 85
50- قيمة طاقة التنشيط للتفاعل الأمامي بوجود عامل مساعد (كيلو جول) تساوي:
51- مقدار الانخفاض في طاقة المعقد المنشط بوجود عامل مساعد (كيلو جول) تساوي:
52- يمثل الرمز (س):
أ) سرعة التفاعل الأمامي بوجود عامل مساعد. ب) سرعة التفاعل الأمامي بدون عامل مساعد.
ج) سرعة التفاعل العكسي بوجود عامل مساعد. د) سرعة التفاعل العكسي بدون عامل مساعد.
53- الناتج العضوي في التفاعل الآتي؛ هو:
أ) CH3CH2CH = CH2 ب) CH3CH = CHCH3
ج) CH3CH2CH2CH3 د) )أ + ب( معاً
54- أي المركبات التالية ينتج أيون كربوني أقل ثباتاً:
55- عند اختزال الكيتونات إلى كحولات ثانوية، يُستخدم NaBH4 في وسط من:
أ) CH3CH2OH ب) CH3OCH3
ج) CH3CH, Cl د) CH2CI2
56- في التفاعل الآتي:
فإن ذرة الهيدروجين في مجموعة OH في الجزيء الناتج، مصدرها:
أ) الإيثر بLiAlH4 ( ج) H3O+ د) كل ما ذُكر
57- أي المركبات الآتية لا ينتج بالتكسير الحراري للألكانات:
أCH2 = CH2 ( بCH4 ( جCH3CH3 ( د) CH3CH2CH3
58- تستخدم كربونات الصوديوم الهيدروجينية NaHCO في الكشف عن المركب:
59- يُعد تفاعل -1 كلوروبروبان مع CH3O- مثالاً على:
أ) الحذف. ب) الاستبدال النيوكليوفيلي. ج) الإضافة الإلكتروفيلية. د) الإضافة النيوكليوفيلية.
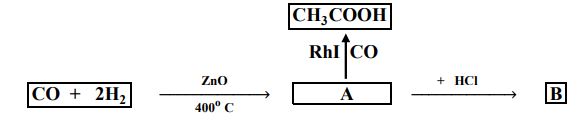
60 - تعتمد الطرق الصناعية في تحضير المركبات العضوية على توفير ظروف وعوامل مساعدة خاصة، ومن الأمثلة على ذلك تحضير حمض الإيثانويك من تفاعل أول أكسيد الكربون والهيدروجين حسب المخطط الآتي:
ما صيغة المركبين المشار إليهما بالرموز B, A على الترتيب:
أCH3OH,CH3COCH3 ( ب) CH3CI,CH3OH
ج) CH3CH2OH,CH3CHO د) CH3CHO,CH3CH2OH
61- يُمكن تحضير المركب -1 كلوروبروبان CH3CH2CH2Cl بخطوة واحدة، باستخدام أحد المركبات التالية:
أ) CH3CH = CH2 ب) CH3CHOHCH3
ج) CH3OCH2CH3 د) CH3CH2CH2OH
62- يحضر المركب 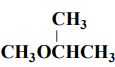
63- سلسلة التفاعلات الصحيحة لتحضير المركب CH3CHO ، بدءاً من CH3CH3 هي:
أ) استبدال – إضافة – أكسدة ب) استبدال - استبدال - اختزال
ج) إضافة – استبدال – اختزال د) استبدال – استبدال – أكسدة
64- سلسلة التفاعلات الصحيحة لتحضير المركبة CH3COCH3 بدءاً من 1- كلوروبروبان هي:
أ) استبدال – استبدال – أكسدة. ج) استبدال - إضافة – حذف – أكسدة.
ب) استبدال - حذف – إضافة – أكسدة. د) استبدال - حذف – إضافة – اختزال.
65- في التفاعل الآتي: CH3CH2CH2Br + H2O A + X؛ فإن الصيغة الكيميائية لكلّ من A و X، هي:
أCH2=CHCH3 / HBr ( بCH3CH2CH3 / Br2 (
ج) CH3CH2CH2OH / Br2 د) CH3CH2CH2OH / HBr