- الهدف من التجربة :
أتعرف إلى طريقة صنع بطارية الليمون
- المواد والأدوات المستخدمة :
- ليمونة كبيرة ناضجة
- صفيحة خارصين Zn
- صفيحة نحاس Cu
- أسلاك توصيل
- مصباح صغير وقاعدته
- سكين
- خطوات العمل :
- أضغط الليمونة باليد إلى أن تصبح طرية تحتوي عصير الليمون
- أعمل في الليمونة ثقبين، ثم أُدخل فيهما صفيحتي الخارصين والنحاس، وأحرص على إدخالهما حتى منتصف الليمونة تقريبًا.
- أُجرب : أصل صفيحة الخارصين بسلك توصيل، ثم أصل طرفه الأخر بقاعدة المصباح.
- ألاحظ: أكرر الخطوة السابقة مع صفيحة النحاس، وأُدون ملاحظاتي : هل أضاء المصباح؟ علام يدل ذلك؟
- شكل بطارية الليمون :
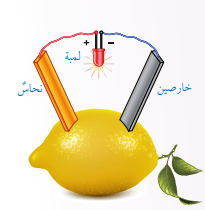
- التحليل والإستنتاج:
1. أتوقع: أي الفلزين يتفاعل مع حمض الليمون(حمض الستريك، وسنرمز له بالرمز HC)
2. أكتب معادلة كيميائية موزونة تمثل تفاعل الفلز مع حمض الستريكHC
3. أكتب معادلة أيونية نهائية لتفاعل الفلز مع الحمض
4. أتوقع: ما التغير الذي حدث للفلز عند تفاعله مع الحمض؟ هل اكتسب أم فقد إلكترونات ؟
5. أتوقع: ما التغير الذي حدث لأيونات الهيدروجين H+ عند تفاعل الحمض مع الفلز؟ هل اكتسبت أم فقدت إلكترونات؟
6. أتوقع: مصدر التيار الكهربائي المتولد في خلية الليمون.
- الملاحظات على التجربة :
1) فلز الخارصين Zn
2)
3)
4) فلز الخارصين Zn فقد إلكترونات وتحول إلى أيون الموجب Zn2+
5) اكتسبت أيونات الهيدروجين H+ إلكترونات وتحولت إلى غاز الهيدروجين H2
6) التفاعل الذي حدث بين الخارصين والحمض HC