الدرس الأول : التفاعلات الكيميائية
- المفاهيم والمصطلحات :
عزيزي الطالب ستتعرف في هذا الدرس على هذه المفاهيم والمصطلحات العلمية :
|
تفاعلٌ كيميائيٌ |
Chemical Reaction |
|
تغيرٌ كيميائيٌ |
Chemical Change |
|
قانونُ حفظِ الكتلةِ |
Low of Conservation of Mass |
|
تفاعلُ الإحتراقِ |
Combustion Reaction |
|
تفاعلُ الإتحادِ |
Combination Reaction |
|
تفاعلُ التحللِ (التفككِ) الحراريٌ |
Thermal Decomposition Reaction |
|
تفاعلٌ الإحلالِ الأحاديٌ |
Single Displacement Reaction |
* التغير الكيميائي (Chemical Change) :
- يطرأ على المادة نوعين من التغيرات وهما :
أ) تغيرات فيزيائية ب) تغيرات كيميائية
أ) التغيرات الفيزيائية :
هي تغيرات تطرأ على الخواص الفيزيائية للمادة مثل حالة المادة ( صلبة، سائلة، غازية ) أو شكل المادة أو حجمها ولا ينتج عنها أي تغير في تركيب المادة أو مكوناتها .
مثال(1) :
تجمد الماء :
تجمد الماء هو تحول الماء من الحالة السائلة للحالة الصلبة وفي كلتا الحالتين؛ بقي ماء
ب) التغيرات الكيميائية :
هي تغيرات تطرأ على تركيب المادة نفسها فينتج عنها مواد جديدة تختلف في صفاتها وخصائصها عن خصائص و صفات المادة الأصلية .
مثال(2) :
- إحتراق عنصر المغنيسيوم (Mg) بوجود غاز الأكسجين (O2)
هذا الإحتراق نتج عنه مادة جديدة على شكل رماد أبيض تسمى بــ ( أكسيد المغنيسيوم (MgO)) وهذه المادة تختلف في خصائصها عن خصائص العنصرين المكونين لها .
المعادلة الكيميائية الممثلة لإحتراق فلز المغنيسيوم بوجود الأكسجين هي :
 <------------
<------------ 
مثال(3) :
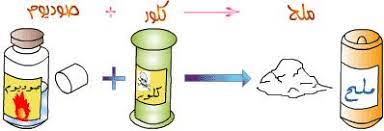
- تفاعل الصوديوم مع الكلور :
الصوديوم (Na) : هو فلز ويمتاز بتفاعله الشديد مع الماء
الكلور (Cl2) : هو غاز سام ذو لون أصفر مخضر
- عند تفاعل العنصرين ينتج مركب كلوريد الصوديوم (ملح الطعام ) الذي يحتاج الجسم اليه
المعادلة التي تمثل هذا التفاعل :
 <---------
<---------  +
+ 
- التفاعل الكيميائي (Chemical Reaction)
- تسمى العملية التي يحدث بها تغير كيميائي بــ (التفاعل الكيميائي )
تعريفه : هو العملية التي يحدث فيها تكسير روابط بين ذرات عناصر المواد المتفاعلة وتكوين روابط جديدة بين ذرات عناصر المواد الناتجة وإعادة ترتيب للذرات دون المساس بنوعها وعددها ، وتختلف الصفات الفيزيائية والكيميائية للمواد الناتجة عنها للمواد المتفاعلة .
مثال (1):
تفاعل غاز الهيدروجين (H2) مع غاز الكلور (Cl2) لإنتاج غاز كلوريد الهيدروجين (HCl) :
المعادلة الموزونة الأتية تمثل التفاعل الحاصل :
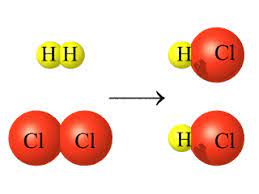
نلاحظ من الرسم تكسر الروابط بين ذرات كل من غاز الهيدروجين (H2) و ذرات غاز الكلور (Cl2) وتكون روابط كيميائية جديدة بين ذرات الهيدروجين وذرات الكلور لإنتاج جزيئات غاز كلوريد الهيدروجين (HCl).
مثال (2) :
تفاعل غاز الهيدروجين (H2) مع غاز الأكسجين (O2) :
المعادلة الموزونة الأتية تمثل التفاعل الحاصل :
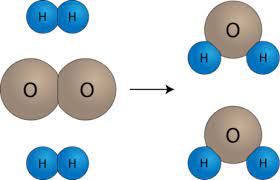
نلاحظ من الرسم تكسر الروابط بين ذرات كل من غاز الهيدروجين (H2) و ذرات غاز الأكسجين (O2) وتكون روابط كيميائية جديدة بين ذرات الهيدروجين وذرات الأكسجين لإنتاج جزيئات الماء (H2O).
المعادلة الكيميائية الموزونة (Chemical Equation Balanced)
- هي الطريقة التي يمكن من خلالها التعبير عن التفاعل الكيميائي
- وهي التعبير بالرموز والصيغ بين المواد المتفاعلة والناتجة ونسب تفاعلها وحالاتها الفيزيائية والظروف التي يجري فيها التفاعل بما يحقق قانون حفظ الكتلة
- قانون حفظ الكتلة :
- ينص على أن " المادة لا تفنى ولا تستحدث من العدم ، وأن مجموع كتل المواد الناتجة يساوي مجموع كتل المواد المتفاعلة "
- يشير هذا القانون إلى أن :
عدد ذرات كل عنصر ونوعها في المواد المتفاعلة يماثل عدد ذراته ونوعها في المواد الناتجة .
مثال (1) :
تفاعل 7g من غاز الأكسجين (O2) مع 93g من الزئبق (Hg) لإعطاء 100g من أكسيد الزئبق (HgO)
مثال (2) :
إحتراق غاز الميثان(CH4) بوجود غاز الأكسجين (O2) لإنتاج غاز ثاني أكسيد الكربون (CO2) وبخار الماء (H2O)
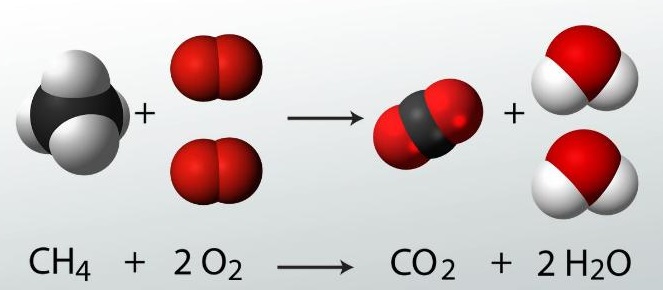
- نلاحظ من الرسم السابق كيف تغير ترتيب الذرات لكنها طبقت قانون حفظ الكتلة حيث أن عدد ذرات عناصر المواد المتفاعلة يساوي عدد ذرات عناصر المواد الناتجة.
- لكتابة المعادلة الكيميائية الموزونة يجب إتباع ما يلي :
1) كتابة معادلة كيميائية لفظية تصف التفاعل.
2) نحول الكلمات إلى رموز وصيغ كيميائية لتصبح معادلة رمزية تتضمن الحالة الفيزيائية لكل مادة .
3) نجري الموازنة للمعادلة بجعل عدد ذرات عناصر المواد المتفاعلة والناتجة من النوع نفسه متساوي على طرفي المعادلة، بطريقة المحاولة والخطأ.
مثال (3) :
أكتب معادلة كيميائية موزونة لتفاعل فلز الفضة (Ag) مع غاز الأكسجين (O2) لأنتاج أكسيد الفضة (Ag2O)
الحل:
1) نكتب معادلة كيميائية لفظية :
فلز الفضة + غاز الأكسجين <------ أكسيد الفضة
2) نحول المعادلة اللفظية لرموز وصيغ كيميائية لتصبح معادلة رمزية تتضمن الحالة الفيزيائية لكل مادة :
3) نجري الموازنة للمعادلة بحيث يكون عدد ذرات عناصر المواد المتفاعلة يساوي عدد ذرات عناصر المواد الناتجة وذلك من خلال طريقة المحاولة والخطأ :
- نلاحظ أن عدد ذرات الفضة والأكسجين في المواد المتفاعلة لا تساوي عدد ذرات الفضة والأكسجين في المواد الناتجة:
-
الذرات
Ag
O
عدد الذرات في المواد المتفاعلة
1
2
عدد الذرات في المواد
الناتجة2
1
- لمساواة عدد الذرات الفضة (Ag) والأكسجين (O) في طرفي المعادلة نستخدم طريقة المحاولة والخطأ :
لذلك إذا قمنا بوضع الرقم 2 أمام الفضة (Ag) وقمنا أيضًا بوضع الرقم 2 أما أكسيد الفضة (Ag2O) فمن الممكن أن تكون المعادلة موزونة ، لنرى :
-
الذرات
Ag
O
عدد الذرات في المواد المتفاعلة
2
2
عدد الذرات في المواد
الناتجة4
2
- نلاحظ أن عدد ذرات الفضة (Ag) في المواد المتفاعل لم يساوي عدد ذرات الفضة في المواد الناتجة لكن عدد ذرات الأكسجين(O) في المواد المتفاعلة يساوي عدد الذرات في المواد الناتجة، لذلك يجب أن نجرب رقم أخر أمام الفضة (Ag) لنحاول بالرقم 4 :
-
الذرات
Ag
O
عدد الذرات في المواد المتفاعلة
4
2
عدد الذرات في المواد
الناتجة4
2
- نلاحظ أن عدد ذرات الفضة (Ag) والأكسجين (O) في المواد المتفاعلة يساوي عدد الذرات في المواد الناتجة.
- نكتب المعادلة الموزونة الأن :
مثال (4) :
أكتب معادلة كيميائية موزونة لتفاعل غاز الميثان CH4 مع غاز الأكسجين (O2) لإنتاج غاز ثاني أكسيد الكربون (CO2) وسائل الماء
الحل:
1) غاز الميثان + غاز الأكسجين ------< غاز ثاني أكسيد الكربون + الماء السائل
2)
3)
|
المواد المتفاعلة |
المواد الناتجة |
|
||
|
الذرات |
عددها |
الذرات |
عدد الذرات |
|
|
CH4 |
C = 1 , H = 4 |
CO2 |
C = 1 , O = 2 |
|
|
O2 |
O = 2 |
H2O |
O = 1 , H = 2 |
|
|
C = 1 , O = 2 , H = 4 |
C = 1 , O = 3 , H = 2 |
المجموع |
||
- نلاحظ أن عدد ذرات الكربون في المواد المتفاعلة يساوي عدد الذرات في المواد الناتجة لكن عدد ذرات الأكسجين والهيدروجين غير متساوي على طرفي المعادلة .
- نبدأ بالمحاولة الأن : ضع الرقم 2 أما الماء السائل (H2O) في المواد الناتجة
-
المواد المتفاعلة
المواد الناتجة
الذرات
عددها
الذرات
عدد الذرات
CH4
C = 1 , H = 4
CO2
C = 1 , O = 2
O2
O = 2
H2O2
O = 2 , H = 2
C = 1 , O = 2 , H = 4
C = 1 , O = 4 , H = 4
المجموع
- نلاحظ بعد وضع الرقم 2 أمام الماء اسائل أصبح عدد ذرات الهيدروجين في المواد المتفاعلة يساوي عدد ذرات الهيدروجين في المواد الناتجة لكن الأكسجين بقي غير متساوي
- ضع الرقم 2 أما غاز الأكسجين (O2) في المواد المتفاعلة .
|
المواد المتفاعلة |
المواد الناتجة |
|
||
|
الذرات |
عددها |
الذرات |
عدد الذرات |
|
|
CH4 |
C = 1 , H = 4 |
CO2 |
C = 1 , O = 2 |
|
|
O22 |
O = 4 |
H2O2 |
O = 2 , H = 2 |
|
|
C = 1 , O = 4 , H = 4 |
C = 1 , O = 4 , H = 4 |
المجموع |
||
- الأن أصبح عدد الذرات في المواد المتفاعلة يساوي عدد الذرات في المواد الناتجة وأصبحت المعادلة موزونة :
- المعادلة الموزونة :
سؤال :
وازن المعادلة الكيميائية التالية :
الحل:
|
المواد المتفاعلة |
المواد الناتجة |
|
||
|
الذرات |
عددها |
الذرات |
عدد الذرات |
|
|
Pb(NO3)2 |
Pb = 1 N = 2 O = 6 |
PbO |
Pb = 1 , O = 1 |
|
|
NO2 |
N = 1 , O = 2 |
|
||
|
O2 |
O = 2 |
|
||
|
Pb = 1 , N = 2 , O = 6 |
Pb = 1 , N = 1 , O = 5 |
المجموع |
||
- نضع الرقم 2 أما مادة نترات الرصاص الثنائية (Pb(NO3)2)
|
المواد المتفاعلة |
المواد الناتجة |
|
||
|
الذرات |
عددها |
الذرات |
عدد الذرات |
|
|
2Pb(NO3)2 |
Pb = 2 N = 4 O = 12 |
PbO |
Pb = 1 , O = 1 |
|
|
NO2 |
N = 1 , O = 2 |
|
||
|
O2 |
O = 2 |
|
||
|
Pb = 2 , N = 4 , O =12 |
Pb = 1 , N = 1 , O = 5 |
المجموع |
||
- والأن نقوم بإضافة الرقم 4 أمام غاز ثنائي اكسيد النيتروجين (NO2)
- و إضافة الرقم 2 أمام مادة أكسيد الرصاص (PbO)
|
المواد المتفاعلة |
المواد الناتجة |
|
||
|
الذرات |
عددها |
الذرات |
عدد الذرات |
|
|
Pb(NO3)22 |
Pb = 2 N = 4 O = 12 |
PbO2 |
Pb = 2 , O = 2 |
|
|
NO24 |
N = 4 , O = 8 |
|
||
|
O2 |
O = 2 |
|
||
|
Pb = 2 , N = 4 , O =12 |
Pb = 2 , N = 4 , O = 12 |
المجموع |
||
- الأن أصبح عدد الذرات العناصر في المواد المتفاعلة والمواد الناتجة متساوية.
- المعادلة الموزونة :
- أنواع التفاعلات الكيميائية :
1) تفاعل الإحتراق (Combustion Reaction)
- تعريفه : هو تفاعل مادة من (عنصر أو مركب) مع غاز الأكسجين ويصاحب التفاعل بشكل عام إنطلاق طاقةٍ في صورة حرارة أو ضوء .
- من الأمثلة على هذا النوع من التفاعلات الكيميائية :
1) إحتراق قطعة من الفحم (فيها عنصر الكربون) بوجود غاز الأكسجين يؤدي إلى إنطلاق حرارة كما في الشكل الأتي :

- يمكن التعبير عن التفاعل السابق بمعادلة كيميائية بالشكل الأتي :
نلاحظ إنطلاق الحرارة بالنواتج
2) إحتراق أنواع الوقود المختلفة
3) إحتراق الخشب وغيرها
- الإستفادة من الحرارة الناتجة من هذه التفاعل :
1) التدفئة
2) تحريك وسائل المواصلات
3) طهي الطعام وغيرها.
4) إحتراق الغذاء في الجسم يزوده بالطاقة اللازمة لأداء وظائفه الحيوية المتنوعة
- ملاحظة :
عادةً عند إحتراق المركبات التي تتكون من الهيدروجين والكربون (الهيدروكربونات ) فإنه ينتج :
(غاز ثاني أكسيد الكربون وبخار الماء ويصاحبه إنطلاق للحرارة )
مثال:
سؤال : علل
عند حرق (g100) من الفحم في كمية معلومة من غاز الأكسجين حرقًا تامًا فإن كمية الناتج تكون أقل من المتوقع :
الإجابة :الجزء المفقود كان على شكل حرارة أو بخار .
- تعريفه : هو تفاعل مادتين أو أكثر (عناصر أو مركبات) لينتج مركبًا واحدًا جديدًا
- من الأمثلة على هذا النوع من التفاعلات الكيميائية :
1) تفاعل عنصر النحاس مع عنصر الكبريت لينتجا مركب كبريتيد النحاس (II) ويعبر عنه بالمعادلة الأتية :
2) تفاعل فلزالصوديوم(Na) مع غاز الأكسجين(O2) لتكوين أكسديد الصوديوم(Na2O) ويعبر عنه بالمعادلة الأتية :
3) تفاعل أكسيد المغنيسيوم (MgO) مع غاز ثاني أكسيد الكربون(CO2)،لإنتاج كربونات المغنيسيوم (MgCO3) ويعبر عنه بالمعادلة الأتية:
- التجربة (1) : ( تفاعل الإتحاد)
- المواد والأدوات المستخدمة :
1) برادة الحديد (Fe) 2) مسحوق الكبريت (ٍS) 3) جفنة تسخين
4) لهب بنسن 5) ملعقة 6) ميزان حساس
7) منصب ثلاثي 8) مغناطيس
- خطوات العمل :
1) أزن 6g من برادة الحديد و 3g من الكبريت وأخلطهما معًا في جفنة التسخين
2) أقرب طرف المغناطيس من الخليط ، وألاحظ أي المادتين تنجذب إليه
3) أضع المادتين مرة أخرى في في الجفنة، وأخلطهما خلطًا جيدًا، وأسخن الجفنة على اللهب لمدة 4 دقائق
ثم أترك الجفنة حتى تبرد، و الأحظ التغير الحادث.
4) أقرب طرف المغناطيس من المادة الموجودة في الجفنة وألاحظ هل تنجذب إليه .
5) ألاحظ وأسجل ملاحظاتي .
- التحليل والإستنتاج :
1) أصف التغير الذي حدث لكل من الحديد والكبريت بعد تسخين مخلوطهما
2) أكتب معادلة كيميائية موزونة تمثل التفاعل الحاصل
- الملاحظات على التجربة :
1) تغير لون برادة الحديد والكبريت ونتج مادة واحدة منهما ذات لون أسود
2) المعادلة الكيميائية الموزونة التي تمثل التفاعل الحاصل :
- تعريفه : هو تحلل مركب واحد بالحرارة منتجًا مادتين أو أكثر وقد تكون النواتج عناصر أو مركبات.
- من الأمثلة على هذا النوع من التفاعلات الكيميائية:
1) تحلل كربونات النحاس بالحرارة منتجة أكسيد النحاس وغاز ثاني أكسيد الكربون ويعبر عن تفاعلها بالمعادلة الأتية :
2) تحلل نترات الأمونيوم بالحرارة منتجة أكسيد ثنائي النيتروجين وبخار الماء ويعبر عن تفاعلها بالمعادلة الأتية:
3) تحلل دايكرومات الأمونيوم (Cr2O72(NH4)( بالحرارة منتجة أكسيد الكروم (Cr2O3) وغاز النيتروجين (N2)
وبخار الماء (H2O) ، ويمكن التعبير عنه بالمعادلة الكيميائية الموزونة الأتية :
- حيث تتسبب الغازات الناتجة فوارانًا يشبه البركان كما في الصورة الأتية :

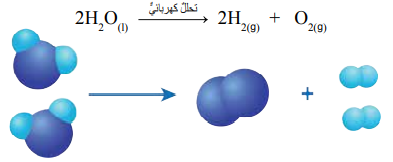
4) قد تعتمد بعض تفاعلات التحلل على إستخدام التيار الكهربائي بدلًا من الحرارة، فمثلًا يتحلل الماء تحللاً كهربائيًا إلى عنصري الهيدروجين والأكسجين كما يأتي :
- التجربة (2) : ( تفاعل التحلل)
- المواد والأدوات المستخدمة :
1) هيدروكسيد النحاس (Cu(OH)2) 2) جفنة تسخين 3) لهب بنسن 4) ملعقة 5) منصب ثلاثي
- خطوات العمل :
1) أضع ملعقة من هيدروكسيد النحاس في الجفنة
2) أسخن الجفنة على اللهب لمدة خمس دقائق، ثم اترك الجفنة حتى تبرد
3) ألاحظ التغير الذي حدث على هيدروكسيد النحاس، ثم أسجل ملاحظاتي
- التحليل والإستنتاج :
1) أصف التغير الذي حدث على المادة المتفاعلة قبل التسخين وبعده
2) أكتب معادلة كيميائية موزونة للتفاعل
- الملاحظات على التجربة :
1) نلاحظ تغير اللون الأزرق إلى اللون الأسود
2) المعادلة الكيميائية الموزونة التي تمثل التفاعل الحاصل :
- بماذا يختلف تفاعل الإتحاد عن تفاعل التحلل الحراري :
- تفاعل الإتحاد : هو تفاعل بين مادتين أو أكثر لإنتاج مادة واحدة جديدة
- تفاعل التحلل : هو عبارة عن مادة واحدة تتحلل منتجة مادتين أو أكثر
- تعريفه : هو تفاعل يحل فيه عنصر نشط محل عنصر أخر أقل نشاطًا منه في محاليل أحد أملاحه
- من الأمثلة على هذا النوع من التفاعلات الكيميائية :
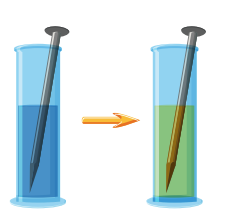
1) عند وضع مسمار من الحديد في محلول كبريتات النحاس II) فإن عنصر الحديد يحل محل أيونات النحاس في المحلول وينتج عن ذلك محلول كبريتات الحديد وتترسب ذرات النحاس كما هو موضح بالصورة الأتية :
- ويعبر عن هذا التفاعل بالمعادلة الكيميائية الموزونة الأتية :
2) تفاعل عنصر النحاس مع محلول نترات الفضة لينتج نترات النحاس وتترسب ذرات الفضة كما في المعادلة الأتية :
3) تترسب ذرات النيكل Ni عند وضع قطعة من عنصر الخارصين Zn في محلول كبريتات النيكل NiSO4
- التجربة (3) : ( تفاعل الإحلال الأحادي )
- المواد والأدوات المستخدمة :
1) كبريتات النحاس(II) (CuSO4) 2) ماء مقطر 3) كأس زجاجية بسعة ml250 4) ملعقة 5) صفيحة خارصين (Zn)
- خطوات العمل :
1) أضع ملعقة من كبريتات النحاس (II) في الكأس الزجاجية وأضيف إليها 20ml من الماء المقطر ثم أحرك الخليط جيدًا حتى يذوب تمامًا
2) ألاحظ التغير الذي حدث لصفيحة الخارصين والمحلول وأسجل ملاحظاتي
- التحليل والإستنتاج :
1) ماذا حدث للون صفيحة الخارصين ولون المحلول في الكأس الزجاجية
2) أكتب معادلة كيميائية موزونة للتفاعل
- الملاحظات على التجربة :
1) إختفاء تدريجي للون المحلول الأزرق ويظهر اللون البني المحمر ، نتيجة ترسب ذرات النحاس على صفيحة الخارصين والمحلول
2) المعادلة الكيميائية الموزونة التي تمثل التفاعل الحاصل :