تطور الجدول الدوري
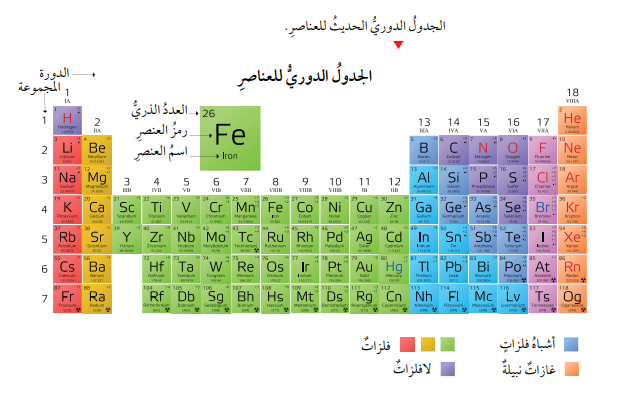
الجدول الدوري: مصفوفة منظمة، صنف العلماء فيها العناصر ورتبوها، لتسهيل دراستها.
- مع تزايد أعداد العناصر المكتشفة، لاحظ العلماء وجود أوجه تشابه بين هذه العناصر من ناحية خصائصها، سواء الفيزيائية أم الكيميائية، وهذا ما تطلب تنظيمها وتصنيفها.
- نشرت النسخة الأولى من الجدول الدوري عام 1869 م ، على يد العالم الروسي دمتري مندليف، رتب فيه العناصر وفقاً لتزايد أعدادها الكتلية.
- لاحظ دمتري وجود تدرج أو دورية في خصائص العناصر المرتبة، أي أن المجموعة الواحدة تمتلك خصائص متشابهة، لكن في تلك الحقبة لم تكن كل العناصر التي نعرفها الآن مكتشفة، لذا، ترك فراغات في جدوله لتلك العناصر، وتوقع خصائصها، فتشجع العلماء من بعده على البحث عنها واكتشافها.

- لاحظ عالم الفيزياء الإنجليزي هنري موزلي أنه يمكن ترتيب العناصر في الجدول الدوري وفقاً لتزايد أعدادها الذرية لا أعدادها الكتلية، وذلك في بداية القرن العشرين، وبذلك تم تطوير جدول مندليف الدوري وتحسينه، فتبين وجود أعداد كبيرة من العناصر لم تكتشف بعد.
- رتبت العناصر في الجدول الدوري وفقاً لتزايد أعدادها الذرية، في صفوف سمي كل صف منها دورة، على أن تتغير خصائص العناصر في الصف الواحد تدريجياً يمكن توقعه، ورتبت العناصر في أعمدة سمي كل عمود منها مجموعة ، على أن تتشابه العناصر الموجودة في العمود الواحد في خصائصها الفيزيائية والكيميائية.
أتحقق صفحة 61: أستنتج الفرق بين ترتيب مندليف، وترتيب موزلي للعناصر في الجدول الدوري.
الجواب: لقد رتب مندليف العناصر وفقاً لتزايد أعدادها الكتلية، في حين رتب موزلي العناصر فيه وفقاً لتزايد أعدادها الذرية.
- ألاحظ أن الجدول الدوري ملون بألوان مختلفة تمثل العناصر الفلزية (الفلزات)، وغير الفلزية (اللافلزات)، وأشباه الفلزات.
- خصائص العناصر الفلزية (الفلزات):
- جميعها صلبة ما عدا الزئبق.
- درجة انصهارها مرتفعة.
- لامعة.
- موصلة جيدة للحرارة والكهرباء.
- قابلة للطرق على هيئة صفائح رقيقة، أو السحب على هيئة أسلاك.
أمثلة عليها:
الحديد (Fe)، الفضة (Ag)، النحاس (Cu)

- خصائص العناصر غير الفلزية (اللافلزات):
- قد تكون سائلة أو غازية أو صلبة هشة عند درجة حرارة الغرفة.
- رديئة التوصيل للحرارة.
- رديئة التوصيل للكهرباء.
أمثلة عليها:
اليود (I)، الكبريت (ٍS)

- أشباه الفلزات: العناصر التي توجد في وسط الجدول الدوري ما بين الفلزات واللافلزات، وهي عناصر تشترك في بعض خصائصها وصفاتها مع الفلزات، وفي بعضها الآخر مع اللافلزات.
أمثلة عليها:
الجرمانيوم (Ge)، السيليكون (Si)
- ملاحظات على الجدول الدوري:
- الدورات في الجدول الدوري
- وضعت العناصر في الجدول الدوري في سبع دورات مرقمة (1-7)، على أن يزداد عدد الإلكترونات لذرات العناصر المتعادلة بمقدار إلكترون واحد عندما أنتقل من عنصر إلى العنصر الذي يليه من اليسار إلى اليمين عبر الدورة الواحدة.
- عناصر الدورة الأولى ينتهي توزيع إلكتروناتها في مستوى الطاقة الأول، وعناصر الدورة الثانية ينتهي توزيع إلكتروناتها في مستوى الطاقة الثاني، وهكذا...
- أمثلة:
- تبدأ الدورة الأولى بعنصر الهيدروجين (H) الذي يحتوي على إلكترون واحد موجود في مستوى طاقته الأول وتنتهي بالهيليوم (He) الذي يحتوي على إلكترونين موجودين في مستوى طاقته الأول أيضاً، وبما أن مستوى الطاقة الخارجي لذرة الهيليوم سيكون مكتملاً، وأي ذرة يكون مستواها الخارجي مكتملاً توصف بأنها مستقرة، أي أن الهيليوم يعد عنصراً مستقراً.
- تبدأ الدورة الثانية بعنصر الليثيوم (Li) الذي يحتوي على 3 إلكترونات، اثنين في مستوى طاقته الأول وواحد في مستوى طاقته الثاني. يليه إلى اليسار عنصر البريليوم (Be) الذي يحتوي على 4 إلكترونات، اثنين في مستوى طاقته الأول واثنين في مستوى طاقته الثاني، وتنتهي بعنصر النيون (Ne) الذي يحتوي على 10 إلكترونات، اثنين في مستوى طاقته الأول، وثمانية في مستوى طاقته الثاني، ولما كان المستوى الثاني يتسع ل 8 إلكترونات في حده الأقصى، فهذا يعني أن الذرة مستقرة، لأن مستوى الطاقة الخارجي مكتمل وممتلىء.
- تبدأ الدورة الثالثة بعنصر الصوديوم (Na) وتنتهي بعنصر الآرجون (Ar) الذي يحتوي على 18 إلكترون، اثنين في مستوى الطاقة الأول ، وثمانية في المستوى الثاني، وثمانية أيضاً في مستوى الطاقة الثالث، ويمكن أن يتسع المستوى الثالث على 18 إلكترون، أي أن التوزيع الإلكتروني لعناصر هذه الدورة ينتهي في مستوى الطاقة الثالث.
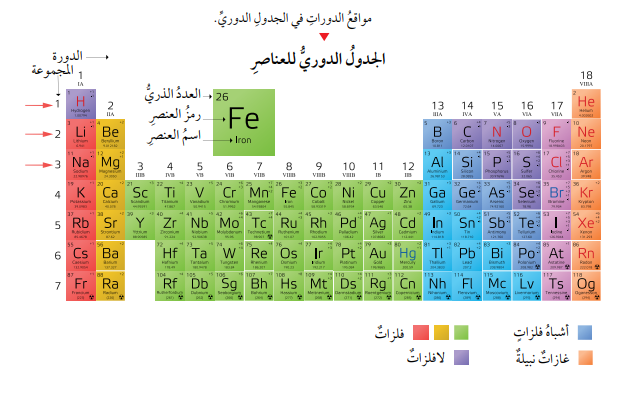
- عدد المستويات الموجودة حول نواة ذرة العنصر هي التي تحدد رقم الدورة (الصف) التي يوجد فيها ذلك العنصر.
- يتكون الجدول الدوري من 18 عمود، ويتكون كل عمود من مجموعة أو عائلة من العناصر، وتتشابه عناصر المجموعة الواحدة في خصائصها الفيزيائية والكيميائية.
أتحقق صفحة 66: أستنتج العلاقة بين عدد مستويات الطاقة حول نوى الذرات، والدورات التي تقع فيها العناصر.
الجواب: عدد المستويات الموجود حول الذرة والتي تتوزع إلكتروناتها فيها هي التي تحدد رقم الدورة التي يوجد فيها ذلك العنصر.
- لاحظ الشكل التالي الذي يمثل مناطق الجدول الدوري:
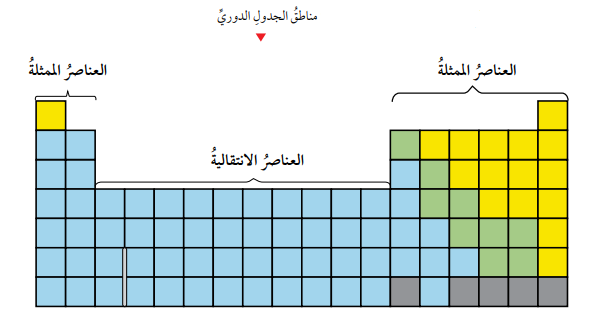
- المجموعات في الجدول الدوري:
- تتضمن المنطقة الأولى (مجموعة العناصر الممثلة) المجموعتين الأولى والثانية، والمجموعات من 13 إلى 18.
- تتضمن المنطقة الثانية (العناصر الانتقالية) المجموعات من 3 إلى 12.
- يتضمن العمود الأول عناصر المجموعة الأولى التي تبدأ بعنصر الليثيوم (Li:2,1) وتحته عنصر الصوديوم (Na:2,8,1)، وعناصر هذه المجموعة صلبة ونشطة في تفاعلاتها، وتحتوي على الكترون واحد في مستوى طاقتها الخارجي، وتسمى مجموعة القلويات.
- يتضمن العمود الثاني عناصر المجموعة الثانية التي تبدأ بعنصر البريليوم (4Be:2,2)وتحته عنصر المغنيسيوم (Mg:2,8,2) وعناصر هذه المجموعة فلزات صلبة، وتحتوي على إلكترونين في مستوى طاقتها الخارجي وتسمى مجموعة القلويات الترابية.
- يتضمن العمود الرابع من العناصر الممثلة، أو العمود الرابع عشر من الجدول الدوري عناصر المجموعة الرابعة، أو الرابعة عشرة التي تبدأ بعنصر الكربون (C:2,4) وتحته عنصر السيليكون (Si:2,8,4) وعناصر هذه المجموعة يمكن أن تكون فلزات أو لافلزات أو أشباه فلزات، وتحتوي 4 إلكترونات في مستوى طاقتها الخارجي، وهكذا.
- الأعمدة من الخامس إلى السابع من العناصر الممثلة، أو الأعمدة من الخامس عشر إلى السابع عشرمن الجدول الدوري تتضمن عناصر المجموعات الخامسة أو الخامسة عشرة، إلى المجموعة السابعة أو السابعة عشرة على التوالي، وعناصر هذه المجموعات يمكن أن تكون لا فلزات، أو أشباه فلزات، وتحتوي على 5 إلكترونات و 6 و 7 على التوالي في مستوى طاقتها الخارجي.
- مثلاً: تبدأ المجموعة السابعة عشرة بعنصر الفلور (F: 2,7)، وتحتوي على 7 إلكترونات في مستوى طاقتها الخارجي.
- كل مجموعة من المجموعات المرتبة في أعمدة في الجدول الدوري تحتوي على عناصر لها العدد نفسه من الإلكترونات في مستوى طاقتها الخارجي، لذا فهي متشابهة في خصائصها الكيميائية.
- عدد الإلكترونات الموجودة في مستوى الطاقة الخارجي لأي عنصر هي التي تحدد رقم المجموعة التي يقع فيها هذا العنصر.
- الكترونات التكافؤ: عدد الإلكترونات الموجودة في مستوى الطاقة الخارجي لأي عنصر.
فالعنصر الذي يحتوي مستوى طاقته الخارجي على إلكتروني تكافؤ يقع في المجموعة الثانية، والعنصر الذي يحتوي مستوى طاقته الخارجي 3 إلكترونات تكافؤ يقع في المجموعة الثالثة، وهكذا......
يبين الجدول التالي يعض العناصر وتوزيعاتها، وعدد مستويات الطاقة فيها، ومجموعاتها التي تقع فيها في الجدول الدوري.
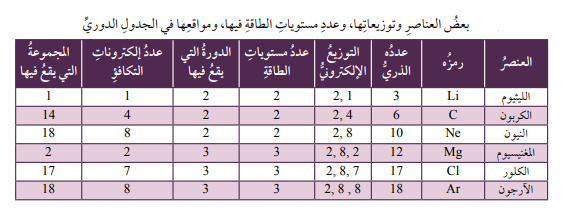
أتحقق صفحة 71: أستنتج العلاقة بين عدد الالكترونات التي يحتويها مستوى الطاقة الخارجي لذرة العنصر والمجموعة التي يقع فيها العنصر وخصائصه.
الجواب: العناصر التي يحتوي مستوى طاقتها الخارجي على إلكترون واحد تقع في المجموعة الأولى، والعناصر التي يحتوي مستوى طاقتها الأخير على إلكترونين تقع في المجموعة الثانية، وهكذا....
تكون الأيونات
الذرات المستقرة: الذرات التي يكون مستوى طاقتها الخارجي ممتلئاً بالحد الأقصى من الإلكترونات.
- فسر: ليست جميع الذرات مستقرة.
الجواب: لأن بعضها لا يمتلك مستوى طاقة خارجي مكتمل وممتلىء بالإلكترونات.
- نلاحظ أن الذرات التي تقع في المجموعة 18 هي فقط التي تمتلك مستويات طاقة خارجية ممتلئة ومكتملة، أي أنها مستقرة، لذا يطلق عليها اسم الغازات الخاملة أو الغازات النبيلة.
- مثال عليها: عنصر النيون (Ne) وعنصر الآرجون (Ar).
- تميل الذرات إلى الوصول إلى حالة الاستقرارعن طريق امتلاك توزيع إلكتروني مشابه للتوزيع الإلكتروني للغازات النبيلة، ويحدث هذا الاستقرار عندما تفقد الذرات الإلكترونات أو تكتسبها، أو تشارك فيها.
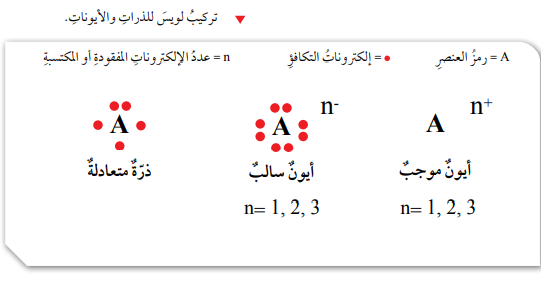
- الأيون: ذرة تفقد أو تكسب إلكترونات من مستوى طاقتها الخارجي، ويمكن أن تكون الأيونات موجبة بفقدها الكترونات أو سالبة بكسبها إلكترونات.
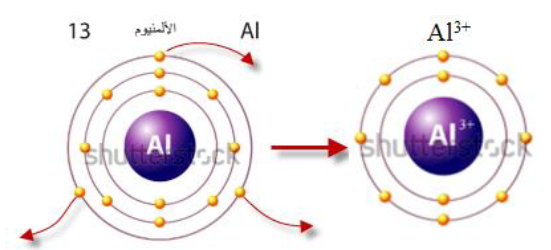
- تكون الأيون الموجب: يتكون الأيون الموجب عندما تفقد الذرة إلكترون واحد أو أكثر، عندئذ تحمل شحنة موجبة بعدد الإلكترونات المفقودة، ويحدث هذا لذرات العناصر التي توجد في المجموعات 1 و2 و13.
مثال:
1. يتكون أيون الصوديوم Na+ عندما تفقد ذرة الصوديوم (11Na: 2,8,1) الإلكترون الموجود في مستوى طاقتها الخارجي، ليصبح توزيعها الإلكتروني مشابهاً لتوزيع ذرة النيون (Ne) المستقرة.
2. يتكون أيون المغنيسيوم Mg+2، عندما تفقد ذرة المغنيسيوم (12Mg: 2,8,2) الإلكترونين الموجودين في مستوى طاقتها الخارجي، ليصبح توزيعها الإلكتروني مشابهاً لتوزيع ذرة النيون (Ne).
أتحقق صفحة 73: أوضح بالرسم كيف يتكون أيون الألمنيوم الموجب.
الجواب:
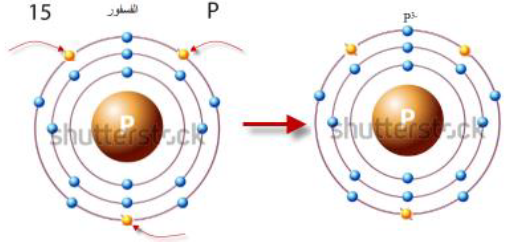
- تكون الأيون السالب: يتكون عندما تكسب الذرة إلكتروناً واحداً أو أكثر، وعندئذ تحمل شحنة سالبة بعدد الإلكترونات التي اكتسبتها، ويحدث هذا لذرات العناصر التي تقع في المجموعات 15 و 16 و 17 من الجدول الدوري.
أمثلة:
- يتكون أيون الكلوريد Cl- عندما تكتسب ذرة الكلور (Cl: 2,8,7) إلكترون واحد ليكتمل به مستواها الخارجي الذي يحتوي على 7 إلكترونات تكافؤ، ويصبح عددها 8، وبذلك يصبح توزويعها الإلكتروني مشابهاً لتوزيع ذرة الآرجون 18Ar المستقرة.
- يتكون أيون الكبريتيد S-2 عندما تكتسب ذرة الكبريت (S:2,8,6) إلكترونين ليكتمل بهما مستواها الخارجي الذي يحتوي على 6 إلكترونات تكافؤ، ويصبح عددها 8، وبذلك يصبح توزويعها الإلكتروني مشابهاً لتوزيع ذرة الآرجون 18Ar المستقرة.
أتحقق صفحة 74: أوضح كيف يتكون أيون الفوسفيد السالب.
الجواب:
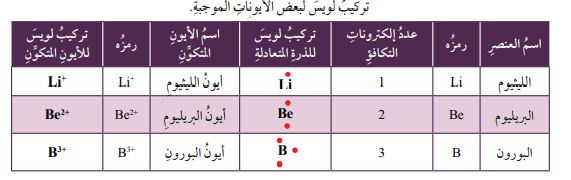
تركيب لويس النقطي للذرات والأيونات
تستغرق عملية رسم مستويات الطاقة وتحديد الإلكترونات عليها وقتاً كبيراً، لا سيما عندما يكون عدد الإلكترونات كبيراً.
- تركيب لويس النقطي: نموذج بسيط يوضح عدد إلكترونات التكافؤ للذرات، يكون فيه رمز ذرة العنصر محاطاً بنقاط تمثل عدد إلكترونات التكافؤ.
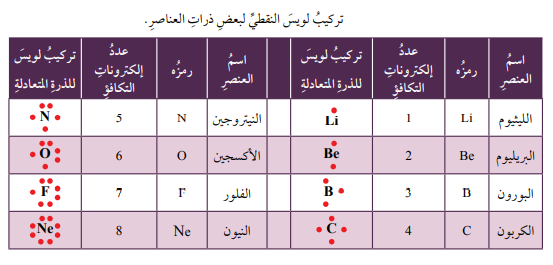
- يمكن التعبير عن ذرات العناصر عن طريق تركيب لويس النقطي بالرجوع إلى الجدول الدوري، فـعناصر المجموعة الأولى تحتوي على إلكترون تكافؤ واحد في مستويات طاقتها الخارجية، وعناصر المجموعة الثانية تحتوي على إلكترونين، وهكذا وصولاً إلى عناصر المجموعة 18 التي تحتوي على 8 إلكترونات، ثم اتبع ما يلي:
- أكتب رمز العنصر أولاً، وأحدد عدد إلكترونات تكافئه الموجودة في مستوى طاقته الخارجي.
- أضع نقاطاً على هيئة أزواج تمثل إلكترونات التكافؤ حول رمز العنصر وعلى جهاته الأربع، على أن أوزع النقاط الأربع الأولى توزيعاً منفرداً.
- أضع النقطة الخامسة بجانب أي نقطة موجودة حول الرمز على أن يمثل ذلك زوجاً من النقاط.
- أستمر في عملية التوزيع وصولاً إلى 8 نقاط حول رمز العنصر على أن تكون على هيئة أزواج على نحو ما هو موضح في الجدول.
- يمكن التعبير عن الأيونات الموجبة أيضاً باستخدام تركيب لويس النقطي، عن طريق:
- نفس الخطوات في حالة الذرة المتعادلة.
- أكتب رمز الذرة المتعادلة أولاً.
- أحدد الإلكترونات التي يمكن أن تفقدها الذرة، وبعد ذلك أزيل النقاط التي حول رمز العنصر، بمقدار عدد الإلكترونات التي سوف تفقدها الذرة.
- أضع إشارة + إلى أعلى يمين رمز العنصر بعدد هذه الإلكترونات المفقودة.
أتحقق صفحة 77: أمثل كيف يتكون أيون الألمنيوم الموجب باستخدام تركيب لويس.
الجواب:
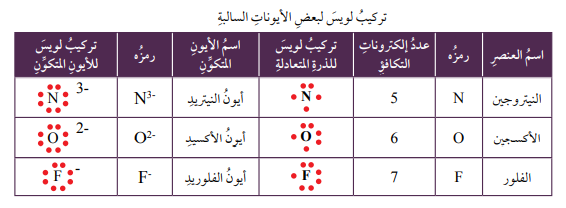
- يمكن التعبير عن الأيونات السالبة باستخدام تركيب لويس النقطي، عن طريق:
- اتباع نفس الخطوات في حالة الذرة المتعادلة.
- أكتب رز الذرة المتعادلة أولاً.
- أحدد الإلكترونات التي يمكن أن تكتسبها الذرة، وبعد ذلك أضيف نقاطاً حول رمز العنصر، بمقدار عدد الإلكترونات التي سوف تكتسبها الذرة.
- أضع إشارة - إلى أعلى يمين رمز العنصر بعدد هذه الإلكترونات المكتسبة.
أتحقق صفحة 78: أمثل كيف يتكون أيون الفوسفيد السالب باستخدام لويس.
الجواب: