الاتزانُ في محاليل الحموض والقواعد الضعيفة:
عرفتَ في ما سبق أنَّ الحموضَ والقواعد الضعيفة تتأيَّنُ جُزئيًا في الماء، وأنَّ ذوبانها يُعَدُّ مثالاً على الاتزان الكيميائي،
وَيُعَبَّرُ عن حالة الاتزان في المحاليل المائيّة للحموض الضعيفة التي تتأيَّنُ جُزئيًّا باستخدام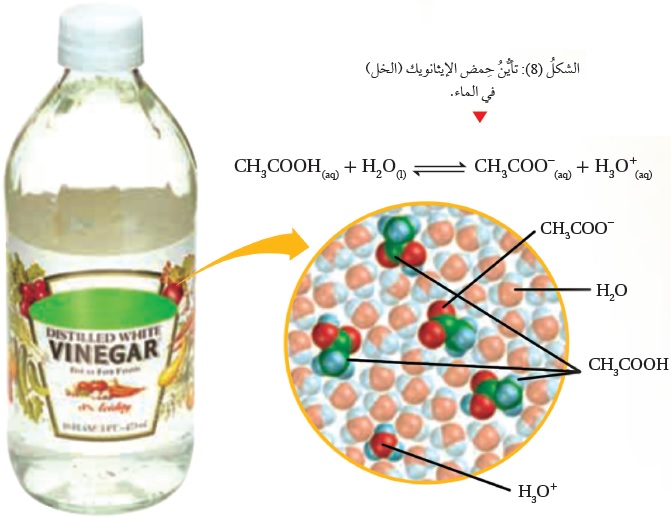
ثابت تأيُّن الحِمض (Ka) الذي يُعَدُّ مقياسًا كَمِّيًّا لتأيُّن الحِمض الضعيف.
انظر الشكل ( 8)، الذي يبيِّنُ تأيُّنَ حِمض الإيثانويك (الخل) CH3COOH.
كما يمكنُ التعبيرُ عن حالة الاتزان لمحاليل القواعد الضعيفة باستخدام
ثابت تأيُّن القاعدة (Kb) وهو يُعَدُّ أيضًا مقياسًا كَمِّيًّا لتأيُّن القاعدة الضعيفة.
فكيف يُستخدَمُ ثابتُ التأيُّن في مقارنة قوّة الحموض الضعيفة أو قوّة القواعد الضعيفة؟
الاتزانُ في محاليل الحموض الضعيفة
تتأيَّنُ الحموضُ الضعيفة جُزئيًّا في الماء، فينتج أيونُ الهيدرونيوم +H3O وأيونٌ آخَرُ سالب،
فإذا رمزنا للحِمض بشكل عام بالرمز HX فإنه يتأيَّنُ، كما في المعادلة الآتية:
HX(aq) + H2O(l) X-(aq) + H3O+(aq)
حِمض مرافق قاعدة مرافقة قاعدة حِمض
وتكون جُزيئات الحِمض غيرُ المتأيِّنة في حالة اتزان معَ الأيونات الناتجة -X و +H3O ،
ويكون موضعُ الاتزان في التفاعل مُزاحًا جهة اليسار (جهة المواد المتفاعلة)؛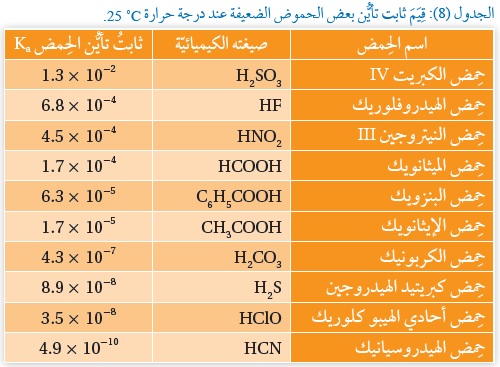
ما يشيرُ إلى أنَّ القاعدة المرافقة (-X) أقوى منَ القاعدة H2O ، وهذا يُمَكِّنُها منَ الارتباط بالبروتون وإعادة تكوين الحِمض بصورة مستمرّة؛ ما يجعلُ تركيزَ الحِمض عاليًا مقارنةً بتركيز الأيونات الناتجة من تأيُّنه.
وَيُعَبَّرُ عن ثابت تأيُّن الحِمض على النَّحو الآتي:
وَيُبَيِّنُ الجدولُ (8) قِيَمَ ثابت تأيُّن بعض الحموض الضعيفة عند درجة حرارة
يُعَبِّرُ ثابتُ تأيُّن الحِمض عن قوة الحِمض وقدرته على التأيُّن،التي تزداد بزيادة قيمة ثابت تأيُّن الحِمض، فكلّما زادت قوّة الحِمض زاد تركيزُ +H3O ، فيزداد بذلك ثابتُ تأيُّن الحِمض Ka ،
وبهذا يمكن مقارنة قوّة الحموض الضعيفة ببعضها، كما يُستفاد من ثابت تأيُّن الحِمض في حساب:
تركيز +H3O ، والرَّقْمِ الهيدروجيني لمحلول الحِمض الضعيف.
إجابة سؤال أتحقق: أدرسُ الجدولَ (6)، ثمَّ أُجيب عنِ الأسئلة الآتية:
1) أُحَدِّدُ الحِمضَ الأقوى: HCOOH أم H2CO3 : الإجابة: HCOOH
2) أتوقعُ أيُّها له أقلُّ رَقْم هيدروجيني: محلول الحِمض HNO2 أم محلول الحِمض HClO. علمًا أنَّ لهما التركيز نفسه.
الإجابة: محلول الحِمض HNO2
3) أتوقعُ أيُّ محاليل الحموض المتساوية التركيز الآتية يحتوي على أعلى تركيز من أيونات : HF, HClO, CH3COOH ؟
الإجابة: محلول الحِمض HClO
كيف يمكن حساب تركيز +H3O ، والرَّقْمِ الهيدروجيني لمحلول الحِمض الضعيف؟
حسابُ تركيز أيون الهيدرونيوم + H3O لمحاليل الحموض الضعيفة:
تنتج أيونات الهيدرونيوم +H3O من تأيُّن الحِمض الضعيف في الماء، ويجري حسابُ تركيزها باستخدام ثابت تأيُّن الحِمض، كما في المثال الآتي:
المثال (16)
أحسبُ تركيزَ أيونات +H3O في محلول حِمض الإيثانويك CH3COOH ، الذي تركيزُه علمًا أنَّ Ka = 1.7 × 10-5
تحليل السؤال:
[CH3COOH] = 0.1 M
Ka = 1.7 × 10-5
[H3O+]المطلوب: حساب
الحل:
أكتبُ معادلة تأيُّن الحِمض:
(aq) +CH3COOH(aq) + H2O(l) CH3COO-(aq) + H3O
التراكيز عند البداية 0 0 0.1M
التغيُّر في التراكيز X + X + X-
التراكيز عند الاتزان X X
أكتبُ ثابت التأيُّن:
وبالتعويض في ثابت التأيُّن نجد أنَّ:
ولمّا كان النقصُ في تركيز الحِمض صغيرًا جدًّا مقارنة بتركيز الحِمض ( 0.1 )، فَيُهمَلُ هذا النقصُ وَيُعتَبَرُ تركيز الحمض ثابتًا؛
أي أنَّ:
وبهذا يمكنُ حسابُ تركيز +H3O ، كما يأتي:
وبأخذ جذرِ الطرفين نجد أنَّ:
أتحقَّق:
أحسبُ تركيزَ أيونات +H3O في محلول حِمض النيتروجين (HNO2 (III ، الذي تركيزُه علمًا أنَّ Ka = 4.5 × 10-4
تحليل السؤال:
0.03 M = [HNO2]
Ka= 4.5 x 10-4
المطلوب: حساب [H3O+]
الحل:
أكتب معادلة تأين الحمض:
HNO2 (aq) + H2O(l) NO2-(aq) + H3O+ (aq)
أكتب ثابت التأين:
وحيث أن النقص في تركيز الحمض صغير جدا ًمقارنة بتركيز الحمض(0.03)، يتم إهمال هذا النقص واعتبار تركيز الحمض ثابتاً، ويساوي 0.03 M
كما أن: [H3O+] = [NO2-] = X
وبالتعويض في ثابت التأين نجد أن:
وبأخذ جذر الطرفين نجد أن:
حسابُ الرَّقْم الهيدروجيني pH لمحاليل الحموض الضعيفة:
يمكن حسابُ الرَّقْم الهيدروجيني للمحلول بالاعتماد على تركيز أيون الهيدرونيوم + H3O ، كما في المثال الآتي:
المثال (17):
أحسبُ الرَّقْمَ الهيدروجيني لمحلول حِمض البنزويك C6H5COOH تركيزُه علمًا أنَّ log 1.12 = 0.05 , Ka = 6.3 × 10-5
تحليل السؤال:
[C6H5COOH] = 2 M
Ka = 6.3 × 10-5
المطلوب: حسابpH للمحلول.
الحل:
أكتبُ معادلة تأيُّن الحِمض:
C6H5COOH(aq) + H2O(l) C6H5COO-(aq) + H3O+ (aq)
2 M 0 0 التراكيز عند البداية
- X + X +X التغيُّر في التراكيز
2- X X X التراكيز عند الاتزان
أكتبُ ثابت التأيُّن:
ولمّا كان [+H3O] = [-C6H5COO] = X فيمكنُ حساب تركيزَ +H3O ، كما يأتي:
أحسبُ الرَّقْمَ الهيدروجيني باستخدام العلاقة:
pH = - log [H3O+]
pH = -log (1.12 × 10-2) = 2 - log 1.12 = 2 - 0.05 = 1.95
حل سؤال أتحقَّق:
أحسبُ الرَّقْمَ الهيدروجيني pH لمحلول حِمض الهيدروسيانيك HCN ، الذي تركيزُه (علمًا أنَّ Log 3.1= 0.49, Ka = 4.9 × 10-10 )
تحليل السؤال:
0.02 M = [HCN]
Ka = 4.9 × 10-10
المطلوب: حساب الرقم الهيدروجينيpH
الحل:
أكتب معادلة تأين الحمض:
HCN (aq) + H2O(l) CN -(aq) + H3O+ (aq)
أكتب ثابت التأين:
وحيث أن النقص في تركيز الحمض صغير جدا ًمقارنة بتركيز الحمض(0.02)، يتم إهمال هذا النقص واعتبار تركيز الحمض ثابتاً، ويساوي 0.02 M
كما أن: [H3O+] = [NO2-] = X
وبالتعويض في ثابت التأين نجد أن:
أحسب الرقم الهيدروجيني باستخدام العلاقة: pH = - log [H3O+]
pH = -log (3.1 × 10-6) = 6 - log 3.1 = 6 - 0.49 = 5.51
استخدامُ الرَّقْمِ الهيدروجيني لحساب كميّة الحِمض أو ثابت التأيُّن Ka :
بمعرفة الرَّقْمِ الهيدروجيني للمحلول يمكنُ حساب كميّة الحِمض اللازمة لتحضيره،
كما يُستفاد منَ الرَّقْم الهيدروجيني أيضًا في حساب ثابت تأين الحمض، والأمثلة الآتية توضِّحُ ذلك:
المثال (18):
أحسبُ كتلة حِمض الميثانويك HCOOH اللازمة لتحضير محلول منه حجمُهُ 1 L وَرَقْمُهُ الهيدروجيني 2.7.
علمًا أنَّ: Ka =1.7 x 10-4 , log 2 = 0.3 , Mr=46 g/mol
تحليل السؤال:
, Ka =1.7 x 10-4 , pH = 2.7 Log 2 = 0.3 , Mr = 46 g/mol
المطلوب: حساب كتلة الحِمض.
الحل:
أكتبُ معادلة تأيُّن الحِمض: HCOOH(aq) + H2O(l) HCOO-(aq) + H3O+ (aq)
يُستفادُ من pH في حساب تركيز +H3O ، كما يأتي:
أحسبُ تركيزَ الحِمض باستخدام ثابت التأيُّن، كما يأتي:
لحساب كتلة الحِمض أحسبُ عددَ مولاته في المحلول، كما يأتي:
أستخدمُ عددَ المولات لحساب كتلة الحِمض، كما يأتي:
المثال (19):
أحسبُ ثابتَ تأيُّن حِمض ضعيف HA رَقْمُهُ الهيدروجيني يساوي 3 حُضِّرَ بإذابة0.1 mol منه في500 mL منَ الماء.
تحليل السؤال:
pH = 3
عدد مولات الحمض HA = 0.1 mol
حجم المحلول (v) = 500 mL = 0.5 L
المطلوب: حساب ثابت تأيُّن الحِمض Ka.
الحل:
أكتبُ معادلة تأيُّن الحِمض: HA(aq) + H2O(l) A-(aq) + H3O+ (aq)
أحسبُ تركيزَ +H3O باستخدام الرَّقْمِ الهيدروجيني، كما يأتي:
أحسبُ تركيزَ الحِمض باستخدام عدد مولاته وحجم المحلول، كما يأتي:
أحسبُ ثابتَ تأيُّن الحِمض، كما يأتي:
حل سؤال أتحقَّق:
أحسبُ كتلة حِمض الكبريت (H2SO3 (IV اللازمة لتحضير محلول منه حجمُهُ وَرَقْمُهُ الهيدروجيني يساوي 2.
علمًا أنَّ 2- Mr = 82 g/mol , Ka =1.3 x 10
تحليل السؤال:
pH = 2
حجم المحلول (v) = 0.5 L
المطلوب: حساب كتلة الحِمض .
الحل:
H2SO3(aq) + H2O(l) HSO3-(aq) + H3O+ (aq) أكتبُ معادلة تأيُّن الحِمض:
يستفاد من pH في حساب تركيز H3O+ كما يلي:
أحسب تركيز الحمض باستخدام ثابت التأين كما يلي:
لحساب كتلة الحمض، أحسب عدد مولاته في المحلول كما يلي:
استخدم عدد المولات لحساب كتلة الحمض كما يلي:
الربط مع الصناعة: تُعَدُّ شركةُ مناجم الفوسفات الأردنيّة رائدةً في إنتاج حِمض الفوسفوريك H3PO4 وحِمض الكبريتيك H2SO4 بتقنيّة عالية في منطقة الشيديّة في جنوبي الأردن، حيث تبلغ كميّة الإنتاج من حِمض الفوسفوريك نحوَ 224 ألف طن سنويًّا، وَقُرابة 660 ألف طن متري من حِمض الكبريتيك تُخَزَّنُ في منشأة خاصَّة بمدينة العقبة؛ وبهذا تُعَدُّ الشركة لبنة أساسيّة في بناء الاقتصاد الوطني لِما لها من إسهامات كبيرة في تطوير صناعة التعدين في الأردن.
الاتزانُ في محاليل القواعد الضعيفة:
تتأيَّنُ القواعدُ الضعيفة جُزئيًّا في المحلول، فينتج أيونُ الهيدروكسيد -OH وأيونٌ آخَرُ موجب، فإذا رمزنا للقاعدة بشكل عام بالرمز B فإنها تتأيَّنُ،
كما في المعادلة الآتية:
B(aq) + H2O(l) BH+(aq) + OH-(aq)
قاعدة مرافقة حِمض مرافق حِمض قاعدة
وتكون جُزيئات القاعدة غير المتأيِّنة في حالة اتزان معَ الأيونات الناتجة -OH و +BH ، ويكون موضعُ الاتزان في التفاعل مزاحاً
جهة اليسار (جهة المواد المتفاعلة)؛ ما يشيرُ إلى أنَّ الحِمض المرافق (+BH) أقوى منَ الحِمض H2O،ويمكنه منحُ البروتون
للقاعدة المرافقة ويعيد تكوين القاعدة (B) في التفاعل باستمرار؛ما يُبقي تركيزَها عاليًا مقارنةً بتركيز الأيونات الناتجة من تأيُّنها،
ويمكن التعبيرُ عن ثابت الاتزان للتفاعل على النَّحو الآتي:
يسمّى ثابتُ الاتزان لتأين القاعدة الضعيفة ثابت تأين القاعدة وَيُرمَزُ له Kb،
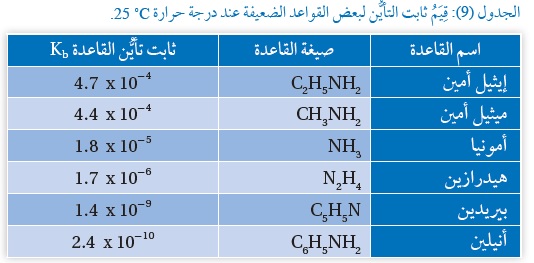
ويبيِّنُ الجدولُ (7) قِيَمَ ثابت التأيُّن لبعض القواعد الضعيفة عند درجة حرارة .
وَيُعَدُّ ثابت التأيُّن مقياسًا كَمِّيًّا لقدرة القاعدة على التأيُّن وإنتاج -OH ، فكلُّما زادت قوّة القاعدة زادت قدرتُها على التأيُّن وإنتاج -OH ، وزاد ثابتُ تأيُّنها Kb و ومن ثَمَّ يقلُّ تركيز
أيونات +H3O ويزداد بذلك الرَّقْمُ الهيدروجيني pH للمحلول،
كيف نستفيد من ثابت تأين القاعدة؟
وَيُستفادُ من ثابت تأيُّن القاعدة في مقارنة قوّة القواعد الضعيفة ببعضها، وفي حساب:
تركيز -OH ، وفي حساب الرَّقْم الهيدروجيني لمحلول القاعدة الضعيفة.
إجابة سؤال أتحقق:
بالرجوع إلى الجدول (7)، أُجيبُ عنِ الأسئلة الآتية:
1) أتوقعُ المحلولَ الذي له أقلُّ رَقْمٍ هيدروجيني NH3 أم C5H5N. علمًا أنَّ لهما التركيز نفسه.
الإجابة: محلول C5H5N
2) أُحَدِّدُ القاعدة الأقوى في الجدول. الإجابة: محلول HC2H5NH2
3) أُحَدِّدُ القاعدة التي يكون حِمضُها المرافقُ له أقلَّ رَقْمٍ هيدروجيني: CH3NH2 أم N2H4 علمًا أن لهما التركيز نفسه.
الإجابة: محلول N2H4
حسابُ تركيز أيونات -OH في محلول قاعدة ضعيفة:
تتأيَّنُ القاعدة الضعيفة جُزئيًّا في الماء، فينتج من تأيُّنها أيونات OH- والحِمضُ المرافق للقاعدة،
ويمكنُ حسابُ تركيز أيونات-OH باستخدام ثابت تأيُّن القاعدة Kb، والمثال الآتي يوضِّحُ ذلك:
المثال (20): تتأيَّنُ الأمونيا في الماء وفقًا للمعادلة الآتية:
NH3(aq) + H2O(l) OH-(aq) + NH4+ (aq)
أحسبُ تركيزَ OH- في محلول الأمونيا NH3 الذي تركيزُه 0.2 M علمًا أنَّ ثابت تأيُّن الأمونيا 5-Kb =1.3 x 10
تحليل السؤال:
المطلوب: حساب [-OH]
الحل:
أكتبُ معادلة تأيُّن القاعدة:
NH3 (aq) + H2O(l) NH4+ (aq) + OH- (aq)
0.2 M 0 0 التراكيز عند البداية
- X + X +X التغيُّر في التراكيز
0.2 - X X X التراكيز عند الاتزان
أكتبُ قانونَ ثابت التأيُّن:
ونظرًا إلى أنَّ قيمة X صغيرةٌ جدًّا مقارنةَ بتركيز القاعدة، فيمكنُ اعتبارُ أنَّ
حل سؤال أتحقق:
تتأيَّنُ الهيدرازينN2H4 ذاتُ التركيز وفقَ المعادلة الآتية:
N2H4(g) + H2O(l) N2H5+(aq) + OH-(aq)
أحسبُ تركيزَ أيونات-OH في المحلول. علمًا أنَّ ثابت تأيُّن الهيدرازين
تحليل السؤال: 0.04 M = [N2H4]
المطلوب: حساب [OH-]
الحل:
أكتب معادلة تأين القاعدة:
N2H4(g) + H2O(l) N2H5+(aq) + OH-(aq)
0.04 M 0 0 التراكيز عند البداية
- X + X +X التغير في التراكيز
0.04 - X X X التراكيز عند الاتزان
أكتب ثابت تأين القاعدة:
ونظرا لأن التغير في تركيز القاعدة يكون صغيرة جدا مقارنة بتركيز القاعدة، فإنه يمكن إهمال هذا التغير
واعتبار تركيز القاعدة ثابتاً، ويساوي M 0.04
ويكون [OH-] = [N2H5+] = X
وبالتعويض في ثابت تأين القاعدة نجد أن:
حسابُ الرَّقْمِ الهيدروجيني pH لمحلول قاعدة ضعيفة:
يعتمد الرَّقْمُ الهيدروجيني لمحلول القاعدة على تركيز أيونات -OH، ويمكنُ حسابُهُ كما في المثال السابق،
ثمَّ أحسبُ تركيزَ أيونات +H3O باستخدام ثابت تأيُّن الماء Kw، ومنه أحسبُ pH، والمثالُ الآتي يوضِّحُ ذلك:
المثال (21): أحسبُ الرَّقْمَ الهيدروجيني لمحلول البيريدين C5H5N، الذي تركيزُه2 M علمًا أنَّ , log 1. 9 = 0.28
تحليل السؤال:
log 1. 9 = 0.28
المطلوب: حساب pH للمحلول.
الحل:
أكتبُ معادلة تأيُّن القاعدة:
C5H5N(aq) + H2O(l) C5H5NH+(aq) + OH- (aq)
2 M 0 0 التراكيز عند البداية
- X + X + X التغيُّر في التراكيز
2- 2- X X X التراكيز عند الاتزان وبما أنَّ[-OH] = [+C5H5NH] = X ، فأكتبُ ثابت التأيُّن كما يأتي:
لحساب الرَّقْم الهيدروجيني لمحلول قاعدة، أحسبُ تركيزَ -OH باستخدام ثابت التأيُّن Kb، كما يأتي:
أحسبُ تركيزَ +H3O باستخدام ثابت تأيُّن الماء Kw، كما يأتي:
أحسبُ الرَّقْمَ الهيدروجيني باستخدام العلاقة: pH = - log [H3O+]
حل سؤال أتحقق:
أحسبُ الرَّقْمَ الهيدروجيني لمحلول الأمونيا NH3، الذي تركيزُه علمًا أنَّ: Kb = 1.8 x 10-5 , log 1.66 = 0.22
تحليل السؤال:
[NH3] = 0.02 M
1.8 x 10-5 = Kb
log 1.66 = 0.22
المطلوب: حساب pH للمحلول.
الحل:
أكتب معادلة تأين القاعدة:
NH3 (aq) + H2O(l) NH4+(aq) + OH- (aq)
0.02 M 0 0 التراكيز عند البداية
- X + X + X التغير في التراكيز
0.02 - X X X التراكيز عند الاتزان
ويكون [OH-] = [NH4+] = X
ونظرا لأن قيمة X صغيرة جدا مقارنة بتركيز القاعدة، يهمل التغير في تركيز القاعدة ويمكن اعتبار أن تركيز القاعدة يبقى ثابتاً، ويساوي M 0.04
أكتب ثابت التأين كما يلي:
لحساب الرقم الهيدروجيني لمحلول قاعدة، أحسب تركيز OH- باستخدام ثابت التأين Kb كما يلي:
أحسب تركيز H3O+ باستخدام ثابت تأين الماء Kw كما يلي:
أحسب الرقم الهيدروجيني باستخدام العلاقة: pH = - log [H3O+]
استخدامُ الرَّقْم الهيدروجيني لحساب كميّة القاعدة أو ثابت التأيُّنKb :
يمكن حسابُ كميّة القاعدة اللازمة لتحضير محلول معيَّن منها بمعرفة الرَّقْم الهيدروجيني للمحلول المراد تحضيرُه،
كما يُستفاد أيضًا منَ الرَّقْم الهيدروجيني لمحلول قاعدة ما في تعيين ثابت تأيُّنها، والأمثلة الآتية توضِّحُ ذلك.
المثال (22): الأنيلين قاعدة تُستخدم في صناعة الأصباغ، صيغتُها C6H5NH2، تتأيَّنُ في الماء كما في المعادلة:
C6H5NH2(aq) + H2O(l) C6H5NH3+ (aq) + OH- (aq)
أحسبُ ثابت تأيُّن الأنيلين لمحلول منها تركيزُه 4 M يحتوي على أيونات OH- تركيزها
تحليل السؤال:
المطلوب: ثابت تأين القاعدة(Kb)
الحل:
أكتبُ ثابتَ تأيُّن القاعدة:
المثال (23): تتأيَّنُ القاعدة إيثيل أمين CH3CH2NH2 وفقَ المعادلة الآتية:
CH3CH2NH2(aq) + H2O(l) CH3CH2NH3+ (aq) + OH-(aq)
أحسبُ تركيزَ القاعدة في محلول منها رَقْمُهُ الهيدروجيني 11. علمًا أنَّ ثابت تأيُّن القاعدة
تحليل السؤال:
المطلوب: أحسبُ تركيزَ القاعدة
الحل:
أكتبُ ثابتَ تأيُّن القاعدة:
لحساب تركيز القاعدة يجب حسابُ تركيز [-OH]؛ ولذلك أحسبُ [+H3O] باستخدام pH، كما يأتي:
حل سؤال أتحقق: أحسبُ ثابتَ تأيُّن القاعدة بيوتيل أمين C4H9NH2، التي تركيزُها وَرَقْمُها الهيدروجيني يساوي 12
تحليل السؤال:
0.4 M = [C4H9NH2]
pH =12
المطلوب: حساب ثابت تأين القاعدة(Kb)
الحل:
أكتب معادلة التأين:
C4H9NH2(aq) + H2O(l) C4H9NH3+ (aq) + OH-(aq)
أحسبُ [+H3O] باستخدام pH، ثم أحسب تركيز [-OH]؛ كما يأتي:
أحسب ثابت تأين قاعدة كما يلي: