الذَّوبانُ Dissolving
- إذا تفحَّصْنا المكوِّناتِ المدوّنةَ على علبةِ الصابون نجدُ أنَّ الصّابونَ يتكوّنُ منْ عدّةِ مكوِّناتِ خُلِطَتْ معًا بانتظامٍ ونِسَبٍ محدّدةٍ، ويطلَقُ على هذا النوعِ منَ المَخاليطِ اسمُ المخلوطِ المتجانِسِ . Homogenous Mixture.
- منَ الأمثلةِ الأُخرى على المَخاليطِ المُتجانِسةِ السكَّرُ المُذابُ في الماءِ.

- إذ تنتشرُ جسيماتُ السكَّرِ بينَ جزيئاتِ الماءِ، وتتوزَّعُ بانتظامٍ، فتبدو كأنَّها اختفتْ؛ إذْ لا يمكنُ رؤيتُها. تُعرَفُ هذهِ العمليَّةُ بالذوبانِ Dissolving ؛ إذْ يذوبُ السكّرُ في الماءِ مُكَوِّنًا
ما يُعرَفُ بالمحلولِ Solution وهوَ مخلوطٌ متجانسٌ يتكوّنُ منْ مُذابٍ ومُذيبٍ، ويكونُ حجمُ جسيماتِ المُذابِ فيهِ صغيرًا جدًّا، ولا يمكنُ تمييزُهُ بالعينِ المجرّدةِ. - يُعرَفُ المذابُ Solute بأنَّهُ المادةُ التي تَتَفَكَّكُ جسيماتُها بعضُها عنْ بعضٍ، وتنتشرُ بينَ جزيئاتِ المذيبِ، وقدْ تكونُ صُلْبةً، أوْ سائلةً، أوْ غازِيَّةً.
- يُعرَفُ المذيب Solvent بأنَّهُ المادّةُ التي تعملُ على تفكيكِ جسيماتِ المُذابِ؛ ففي مَحلولِ السكّرِ والماءِ يكونُ الماءُ هوَ المذيبَ والسكّرُ هوَ المذابَ.
أتحقَّقُ: ما المقصودُ بعمليّةِ الذوبانِ؟
الذوبان: انتشار جسيمات المذاب بانتظام بين جزيئات المذيب.
تجربة : مفهومُ الذوبانِ
الموادُّ والأدواتُ:
ماءٌ مقطّرٌ، وملحُ الطعامِ، وسكرُ المائدةِ، ورملٌ، وثلاثُ كؤوسٍ زجاجيّةٍ مرقّمَةٍ سعةُ كلٍّ منْها ( 200ml)، وملعقةٌ صغيرةٌ.
إرشاداتُ السلامةِ:
- أغسلُ يديَّ بعدَ الانتهاءِ منَ التجربةِ.
- أحذرُ تذوُّقَ الموادِّ.
خطواتُ العملِ:
1 . أقيسُ: أضعُ ( 200mL) منَ الماءِ المقطَّرِ في كلِّ كأسٍ على حِدَةٍ.
2. أُضيفُ ملعقةَ ملحِ طعامٍ صغيرةً إلى الماءِ المقطرِ في الكأسِ ( 1)، معَ التحريكِ باستمرارٍ، ثمَّ أُدوِّنُ ملاحظاتي.
3. أكرِّرُ الخطوتينِ السابقتينِ بإضافةِ ملعقةِ سكّرٍ إلى الكأسِ ( 2)، وملعقةِ رملٍ إلى الكأسِ ( 3)، وأُدوِّنُ ملاحظاتي في كلِّ مرَّةٍ.
التحليلُ والاستنتاجُ:
1. أيُّ الموادِّ يمكنُ تمييزُها في المخلوطِ بالعينِ المجرّدةِ؟
الرمل
2. أيُّ الموادِّ انتشرتْ جسيماتُها بينَ جزيئاتِ الماءِ ولا يمكنُ تمييزُها في المخلوطِ؟
السكر والملح
3. ما المقصودُ بالذوبانِ؟
انتشار جسيمات المذاب بانتظام بين جزيئات المذيب.
4. هلْ تذوبُ السوائلُ في الماءِ؟ أصمّمُ -بالتعاونِ معَ زملائي- تجربةً أختبرُ فيها قابليَّةَ ذوبانِ السوائلِ في الماءِ، ثمَّ أُدوِّنُ نتائجَ تجربتي، ثمَّ أناقشُها معَ معلِّمي.
اطلب إلى الطلبة في مجموعاتهم اختبار قابلية ذوبان بعض السوائل في الماء مثل(الخل، الزيت) وتسجيل ملاحظاتهم واستنتاجهم .
تركيزُ المحلولِ Concentration of Solution
- يُعَدُّ الماءُ مُذيبًا جيِّدًا لكثيرٍ منَ الموادِّ الصُّلْبةِ والسائلةِ والغازيّةِ.
- تسمّى المحاليلُ التي يكونُ الماءُ فيها مُذيبًا المحاليلَ المائيّةَ، ولها أهميةٌ كبيرةٌ في مجالاتِ التفاعلات والتطبيقاتِ الصناعيّةِ. فعندَ تفحُّصِ إحدى عُلبِ العصيرِ أوْ زجاجاتِ الماءِ ألاحظُ وجودَ معلوماتٍ عنِ الموادِّ المُذابَةِ فيهِ، ولكلٍّ منْها كمّيّةٌ محددّةٌ بالنسبةِ إلى المحلولِ.
- يُستخدَمُ مفهومُ تركيزِ المحلولِ Concentration of Solution للتعبيرِ عنِ العلاقةِ بينَ كمّيّتَيِ المُذابِ والمُذيبِ في المحلولِ.
- عندَ تحضيرِ المحاليلِ في الصناعاتِ المختلفةِ، فإنَّهُ منَ الضّروريِّ تحديدُ كمّيّتَيِ المُذابِ والمُذيبِ في المحلولِ لحسابِ تركيزِهِ.
- منَ الطرائقِ المستخدَمةِ لحسابِ تركيزِ المحاليلِ حسابُ نسبةِ كتلةِ المُذابِ بالغرامِ (g) إلى حجمِ المحلولِ بالملليترِ (mL)، وتكونُ وحدةُ التركيزِ (g/mL)، كما في العلاقةِ
الرياضيّةِ الآتيةِ: تركيزُ المحلولِ = كتلةَ المذابِ (g) / حجمِ المحلوِل (mL)
فإذا رُمِزَ إلى التركيزِ بالرمزِ(C)، وكتلةِ المذابِ بالرمزِ(m) وحجمِ المحلولِ بالرمزِ (V)، فإنَّ العلاقةَ الرياضيّةَ تُكتَبُ بالرموز :
مثال 1
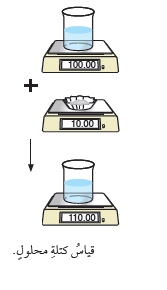
أُذيبَ ( 10g) منَ السكَّرِ في كمّيّةٍ منَ الماءِ النقيِّ، فتكوَّنَ محلولٌ حجمُهُ ( 110mL). أحسُبُ تركيزَ المحلولِ.
المُعطياتُ :
m = 10g
V = 110 mL
الخطواتُ:
=0.09g / mL
- عندَ قياسِ كتلةِ المحلولِ الناتجِ منْ إذابةِ كمّيّةٍ منَ السكَّرِ في الماءِ نجدُ أنَّهُ يساوي مجموعَ كتلةِ الماءِ النقيِّ وكتلةِ السكّرِ المذابِ، وهذا يثبتُ أنَّ السكّرَ يحتفظُ بوجودِهِ في الماءِ، وأنَّ جسيماتِهِ انتشرتْ بينَ جزيئاتِ الماءِ بانتظامٍ في عمليّةِ الذوبانِ.
أتحقَّقُ: أُذيبَ ( 30g) منْ ملحِ الطعامِ في كمّيّةٍ كافيةٍ منَ الماءِ فتكوَّنَ محلولٌ تركيزُهُ ( 0.3g /mL)، أحسُبُ حجمَ المحلولِ بوحدةِ اللّترِ؟
المعطيات : C= 0.3g\mL ، m= 30g
المطلوب: حجم المحلول بوحدة اللتر.
الحل :
الحل :
V= 100ml
للتحويل إلى لتر نقسم
v=0.1l
تجربة : مفهومُ الذائبيةِ
الموادُّ والأدواتُ: ماءٌ مقطرٌ، وملحُ الطعامِ، وكبريتاتُ النحاسِ CuSO4 ، وسكرُ المائدةِ، وكأسٌ زجاجيةٌ سعتُها ( 200mL )، وملعقةٌ، وميزانٌ إلكترونيٌّ.
إرشاداتُ السلامةِ:
أحذرُ عندَ التعاملِ معَ الكؤوسِ الزجاجيّةِ، وأحذرُ تذوُّقَ الموادِّ، وأغسلُ يديَّ بعدَ الانتهاءِ منَ التجربةِ.
خطواتُ العملِ:
1. أضعُ في إحدى الكؤوسِ الزجاجيّةِ ( 100g) منَ الماءِ المقطّرِ.
2. أقيسُ باستخدامِ الميزانِ الإلكترونيِّ كتلةَ(10g)منْ ملحِ الطعامِ.
3. أُلاحِظُ: أضيفُ ملحَ الطعامِ إلى الماءِ الذي في الكأسِ الزجاجيّةِ، وأُحرِّكُهُ حتى يذوبَ الملحُ تمامًا، وأُكرِّرُ ذلكَ إلى أنْ أُلاحِظَ ظهورَ راسبٍ منْ ملحِ الطعامِ. ما كميّةُ ملحِ الطعامِ التي أُذيبَتْ في الماءِ؟
4. أُجرِّبُ: أُكرِّرُ الخطواتِ باستخدامِ ملحِ كبريتاتِ النحاسِ CuSO4 مرَّةً، وسكّرِ المائدةِ مرَّةً أُخرى.
5. أُدوِّنُ كتلةَ المذابِ التي أُذيبَتْ في الماءِ لكلِّ مادّةٍ عندَ درجةِ حرارةِ الغرفةِ 25 °C ، ثمَّ أُنظِّمُ البياناتِ التي حصلتُ عليها في جدولٍ.
التحليلُ والاستنتاجُ:
1. ما المقصودُ بذائبيّةِ الموادِّ الصُّلْبةِ في الماءِ؟
الذائبية: أكبر كمية من المذاب تذوب في 100g من الماء المقطر عند درجة حرارة معينة.
2. ما أكبرُ كمّيّةٍ منْ ملحِ الطعامِ يمكنُ أنْ تذوبَ في لترٍ منَ الماءِ عندَ درجةِ الحرارةِ نفسِها ؟
لحساب أكبر كمية من ملح الطعام تذوب في لتر من الماء عند درجة حرارة الغرفة:
38g من ملح الطعام تذوب في 100g من الماء
بالضرب التبادلي :
m× 100 = 38× 1000
m= 380g
3. كيفَ يمكنُني إذابةُ المادةِ المترسِّبة؟
عند تسخين المحلول تذوب المادة المترسبة.
الذائبيةُ والعواملُ المؤثِّرةُ فيها Solubility & Affecting Factors
- عندَ أُضافُة كميّةً قليلةً منَ الملحِ إلى كأسٍ تحوي ماءً في درجةِ حرارةِ الغرفةِ فإنَّها تذوبُ فيهِ، وإذا أضفْتُ كميّاتٍ أخرى منَ الملحِ إلى الكأسِ نفسِها فإنَّ المحلولَ يصلُ إلى حدٍّ لا يمكنُهُ أنْ يذيبَ فيهِ أيَّ كميّاتٍ إضافيةٍ منَ الملحِ، ويُسمّى عندئذٍ المحلولَ المُشبَعَ ( Saturated Solution ).
- أمّا إذا أضفْتُ كميّةً أخرى منَ الملحِ إلى المحلولِ المُشبَعِ فإنَّها تترسَّبُ في قعرِ الكأسِ، ويُسمّى عندئذٍ المحلولَ فوقَ المُشبَعِ.

- تُسمّى أكبرُ كتلةٍ منَ المذابِ التي تذوبُ في ( 100g) منَ الماءِ عندَ درجةِ حرارةٍ معيّنةٍ الذائبيةَ Solubility
- تتأثّرُ ذائبيّةُ الموادِّ الصُّلْبةِ في الماءِ بعواملَ عدَّةٍ، منْها: درجةُ الحرارةِ، وطبيعةُ المادَّةِ.
درجةُ الحرارةِ Temperature
- عندَ إعدادِ محلولِ شرابِ السكّرِ(القَطْرِ) تُضافُ كمّيّةٌ كبيرةٌ منَ السكّرِ إلى حجمٍ محدَّدٍ منَ الماءِ.
- لتتمَّ عمليّةُ الذوبانِ يُسَخَّنُ المحلولُ؛ إذْ تزدادُ ذائبيّةُ معظمِ الموادِّ الصُّلْبةِ في الماءِ بارتفاعِ درجةِ الحرارةِ.
- عندَ تسخينِ المحلولِ تزدادُ حركةُ جزيئاتِ الماءِ؛ ما يزيدُ المسافاتِ والفراغاتِ بينَها، فتستوعبُ كميّاتٍ أكبرَ منْ جسيماتِ المذابِ التي تنتشرُ وتتوزَّعُ بانتظامٍ بينَ جزيئاتِ الماءِ في المحلولِ.
أتأمل الشكل : أتأمَّلُ الرسمَ البيانيَّ الآتيَ مبيِّنًا ذائبيّةَ السكّرِ عندَ درجةِ حرارةِ 50 °C و 70°C .
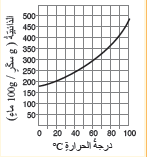
الذائبية عندَ درجةِ حرارةِ 50 °C = تقريبا 270 ماء g/100g
الذائبية عندَ درجةِ حرارةِ 70 °C = تقريبا 400 ماء g/100g
طبيعةُ المادّةِ Nature of Matter
- تختلفُ الموادُّ في ذائبيَّتِها باختلافِ طبيعةِ كلٍّ منْها؛ فلكلِّ مادةٍ ذائبيَّةٌ خاصَّةٌ بها.
- يمكنُ زيادةُ سرعةِ ذوبانِ المادةِ الصُّلْبةِ في الماءِ بطحنِها، وتحويلِها إلى مسحوقٍ؛ إذْ تزدادُ مساحةُ سطحِ المادّةِ المُذابةِ فتلامِسُ عددًا أكبرَ منْ جزيئاتِ الماءِ، وتزدادُ سرعةُ ذوبانِها. فسرعةُ ذوبانِ السكّرِ المطحونِ في ( 100g) منَ الماءِ عندَ درجةِ حرارةِ الغرفةِ أكبرُ منْ سرعةِ ذوبانِ مكعبِ السكّرِ عندَ الظروفِ نفسِها.
أتأمل الشكل : أيُّ الأملاحِ لهُ أعلى ذائبيَّةٍ عندَ درجةِ حرارةِ 75°C ؟
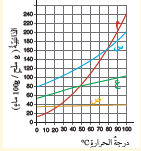
الملح ( م )
تجربة : العواملُ التي تؤثِّرُ في سرعةِ الذوبانِ
أصوغُ فرضِيّتي: كيفَ تُؤثِّرُ مساحةُ سطحِ المادةِ المذابةِ في سرعةِ ذوبانهِا في الماءِ؟
أُدوِّنُ توقُّعاتي: تزدادُ سرعةُ ذوبانِ المادةِ الصُّلْبةِ في الماءِ كلَّما ............... مساحةُ سطحِها الملامسةُ لجزيئاتِ الماءِ.
الموادُّ والأدواتُ: مكعبُ سكّرٍ، وسكّرٌ مطحونٌ خشنٌ، وسكّرٌ مطحونٌ ناعمٌ، وميزانٌ إلكترونيٌّ، وماءٌ في درجةِ حرارةِ الغرفةِ، ومِخْبارٌ مُدرَّجٌ، وكؤوسٌ زجاجيَّةٌ مرقَّمةٌ ( 1، 2، 3) وساعةُ توقيتٍ.
إرشاداتُ السلامةِ:
- أحرصُ على غَسْلِ يديَّ عندَ الانتهاءِ منْ تنفيذِ الخطواتِ.
- أحذرُ عندَ التعاملِ معَ الأدوات الزجاجيّةِ.
خطواتُ العملِ:
1. أقيسُ باستخدامِ المخبارِ المُدرَّجِ ( 100mL ) منَ الماءِ في درجةِ حرارةِ الغرفةِ، ثمَّ أضعُهُ في الكأسِ ( 1).
2. أقيسُ كتلةَ مكعبِ السكّرِ باستخدامِ الميزانِ الإلكترونيِّ، ثمَّ أضعُهُ في الكأسِ.
3. أحسبُ باستخدامِ ساعةِ التوقيتِ الزَّمنَ اللازمَ لذوبانِ مكعبِ السكّرِ كلِّهِ، أفترضُ أنَّها تجربةٌ ضابطةٌ لزمنِ الذوبانِ، ثمَّ أُدوِّنُ هذا الزمنَ في الجدولِ.
4. أكرِّرُ الخطواتِ السابقةَ مستخدمًا الكتلةَ نفسَها منْ سكّرٍ مطحونٍ خشنٍ، ثمَّ سكّرٍ مطحونٍ ناعمٍ.
التحليلُ والاستنتاجُ:
1. أمثِّلُ بيانيًّا بالأعمدةِ النتائجَ السابقةَ التي تمثِّلُ العلاقةَ بينَ الزمنِ اللازمِ للذوبانِ ومساحةِ سطحِ المادةِ الصُّلْبةِ المذابةِ.
2. أفسِّرُ البياناتِ مُحدِّدًا أيَّها استغرقَ زمنًا أقلَّ للذوبانِ في الماءِ.
لأن حجم حبيبات السكر المطحون الصغيرة تكون فيها مساحة السطح المعرضة للذوبان أكبر فتزداد مِساحةُ سطحِ المادّةِ المُذابةِ التي تنتشر بين جزيئاتِ الماءِ، فتزدادُ كمية المذاب كلما قل حجم حبيباته .
3. ما تأثيرُ درجةِ الحرارةِ في زمنِ الذوبانِ؟ أصمّمُ تجربةً لمعرفةِ ذلكَ، ثمَّ أُدوِّنُ ملاحظاتي في جدولٍ.
تزداد الذائبية بزيادة درجة الحرارة يتم توجيه الطلبة إلى الأدوات والمواد التي يمكن أن يستخدموها في تصميم تجربة؛ لاختبار عامل آخر من العوامل التي تؤثر في الذائبية.
ذائبيةُ الغازاتِ في الماءِ Solubility of Gases in Water
- يُذيبُ الماءُ كثيرًا منْ غازاتِ الهواءِ الجويِّ مثلِ غازِ الأكسجينِ وغازِ ثاني أكسيدِ الكربونِ؛ إذْ تحتاجُ إليْها الكائناتُ الحيةُ التي تعيشُ في الماءِ للتنفُّسِ والبناءِ الضوئيِّ.
- تُعرَّفُ ذائبيةُ الغازاتِ (Solubility of Gases) بِأنَّها أكبرُ كمّيّةٍ مِنَ الغازِ تذوبُ في لِترٍ منَ الماءِ عندَ درجةِ حرارةٍ معيَّنةٍ وضغطٍ جويٍّ محدَّدٍ.
- تتأثَّرُ ذائبيةُ الغازاتِ بعدَّةِ عواملَ، منْها الضّغطُ الواقعُ عليها؛ فكلَّما زادَ الضغطُ زادتْ ذائبيَّةُ الغازِ في الماءِ عندَ درجةِ حرارةٍ معيّنَةٍ، ولذلكَ عندَ فَتْحِ علبةِ مشروبٍ غازيٍّ ألاحظُ خروجَ فقاعاتِ غازٍ، وإذا تركْتُها مدَّةً منَ الزمنِ ستتصاعدُ فقاعاتٌ أكثرُ منَ الغازِ، وعندَما أتذوَّقُ المشروبَ الغازيَّ أجدُ طعمَهُ غيرَ مُستساغٍ بسببِ خروجِ الغازِ منْهُ، وتقلُّ ذائبيَّةُ الغازاتِ في الماءِ بزيادةِ درجةِ الحرارةِ، وهذا يفسِّرُ خروجَ فقاعاتٍ غازيّةٍ عندَ تسخينِ الماءِ؛ إذْ تقلُّ ذائبيّةُ الغازاتِ الذائبةِ في الماءِ، وتظهرُ على شكلِ فقاعاتٍ

أتحقَّقُ: أُقارنُ بينَ تأثيرِ ارتفاعِ درجةِ الحرارةِ في ذائبيةِ الموادِّ الصُّلْبةِ وذائبيةِ الغازاتِ في الماءِ.
عند ارتفاع درجة الحرارة تزداد ذائبية معظم المواد الصلبة في الماء، وتقل ذائبية المواد الغازية فيه.
استخلاصُ الأملاحِ Salts Extraction
تحتوي مياهُ البحارِ على كثيرٍ منَ الأملاحِ التي يمكنُ الاستفادةُ منْها في مجالاتِ الصناعةِ، ويمكنُ فصلُ الأملاحِ عنِ الماءِ بطرائقَ عدَّةٍ ، أهمُّها: التّبخُّرُ، والتقطيرُ.
التبخُّرُ Evaporation
- تُستخدمُ الطاقةُ الشمسيّةُ للحصولِ على أملاح البحرِ الميتِ في الأردنِّ وذلك بتعريضِ مياهِ البحرِ إلى أشعّةِ الشمسِ، فيتبخّرُ الماءُ وتترَّسبُ الأملاح بالتدريجِ وفقَ الاختلافِ في ذائبيَّتِها في أحواضٍ خاصَّةٍ تُسمّى المَلّحاتِ، ثمَّ تُستخلَصُ بطرائقَ كيميائيّةٍ خاصَّةٍ للاستفادَةِ منْها في صناعاتٍ عَديدةٍ.

التقطيرُ Distillation
- تُعَدُّ عمليّةُ التقطيرِ منْ أكثرِ الطرائقِ فعاليةً لاستخلاصِ الأملاح منْ محاليلِها المائيّةِ. ويتمُّ في عمليةِ التّقطيرِ تبخيرُ الماءِ وتكثيفُ بخارِهِ؛ للحصولِ على الماءِ النقيِّ. في جهازِ تقطيرِ الماءِ ، كما في الشكلِ أدناه
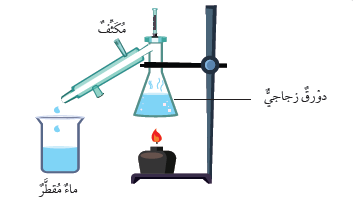
- يتبخَّرُ الماءُ عندَ تسخينِ المحلولِ، ويتصاعدُ بخارُ الماءِ إلى داخلِ المكثّفِ (سطحٌ باردٌ)، فيتكاثفُ، ويتحوّلُ إلى ماءٍ مقطّرٍ (نقيٍّ) يتجمَّعُ في الكأسِ الزجاجيّةِ، وتترسَّبُ الموادُّ الصُّلْبةُ في الدورقِ، وبهذهِ الطريقةِ يمكنُ الحصولُ على الأملاحِ ، إضافةً إلى ماءٍ نقيٍّ بدرجةٍ عاليةٍ .
تجربة :استخلاصُ الأملاحِ منَ المحلولِ بالتقطيرِ
الموادُّ والأدواتُ: جهازُ تقطيرِ الماءِ، ومحلولُ كبريتاتِ النحاسِ، ورملٌ، وملحٌ، ومخبارٌ مدرَّجٌ، وموقدُ بنسن، ومنْصَبٌ ثلاثيٌّ، وشبكةُ تسخينٍ.
إرشاداتُ السلامةِ: أحذرُ الماءَ الساخنَ في أثناءِ تسخينِ المحلولِ.
خطواتُ العملِ:
1. أقيسُ ( 100mL ) مِنْ محلولِ كبريتاتِ النحاسِ، ثمَّ أضعُ هذهِ الكميّةَ في دورقِ التقطيرِ.
2. أجرِّبُ: أُرَكِّبُ جهازَ التقطيرِ كما في الشكلِ مستعينًا بمعلِّمي.
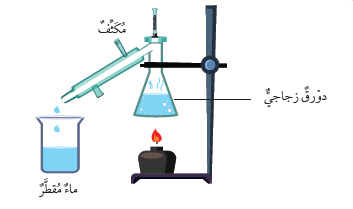
3. أسخِّنُ الدورقَ، حتّى يقاربَ الماءُ في المحلولِ على الانتهاءِ، ويتجمَّعَ في الكأسِ الزجاجيَّةِ.
4. ألاحظُ المادةَ المتبقيةَ في الدورقِ، ثمَّ أُدوِّنُ ملاحظاتي.
التحليلُ والاستنتاجُ:
1. ما العملياتُ التي حدثتْ في جهازِ التقطيv?
التبخر والتكثف
2. ما نواتجُ عمليّةِ التقطيرِ؟
الماء والملح
3. هلِ الماءُ الذي في الكأسِ الزجاجيّةِ نقيٌّ أمْ غيرُ نقيٍّ؟
ماء نقي
4. أستنتجُ: ما أهميّةُ المكثِّفِ في جهازِ التقطيرِ؟
يعمل المكثف عملَ سطح بارد يتكاثف عليه بخار الماء المتصاعد من الدورق.