الروابط الكيميائية
الرابطة الكيميائية: قوة تجاذب تنشأ بين ذرتين من خلال فقد الذرة للإلكترونات أو اكتسابها، أو المشاركة بها مع ذرة أخرى.
الرابطة الأيونية
الرابطة الأيونية: قوة الجذب التي تنشأ بين الأيون الموجب والأيون السالب، وتتكون الرابطة الأيونية بين أيوني ذرتين (فلز ولا فلز).
مثال1:
أوضح كيف تنشأ الرابطة الأيونية بين المغنيسيوم والفلور في مركب فلوريد المغنيسيوم MgF2.
الحل:
- التوزيع الإلكتروني لذرة المغنيسيوم هو(Mg:2,8,2) ، تميل إلى فقد إلكترونين من مستوى الطاقة الأخير حتى تصل إلى حالة الاستقرار، وتكون أيون المغنيسيوم الموجب (Mg+2).
- التوزيع الإلكتروني لذرة الفلور هو (F:2,7)، تميل إلى كسب إلكترون واحد حتى تصل إلى حالة الاستقرار، وتكون أيون الفلوريد السالب (F-).
تنشـأ بين الأيونين الموجب والسالب قوة تجاذب تسمى الرابطة الأيونية، وحتى تتساوى الشحنات الموجبة والسالبة، أي يبقى المجموع الجبري لشحنات المركب يساوي صفراً، فإن أيون المغنيسيوم (Mg+2) لا بد من أن يرتبط بأيوني فلوريد (F-) ، وتكون صيغة المركب الناتج (MgF2).
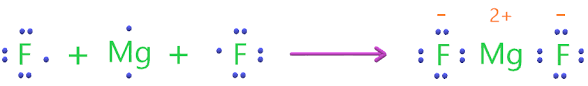
مثال2:
أوضح كيف تنشأ الرابطة الأيونية بين الليثيوم والكلور في مركب كلوريد الليثيوم LiCl.
الحل:
- التوزيع الإلكتروني لذرة الليثيوم هو(Li:2,1) ، تميل إلى فقد إلكترون واحد من مستوى الطاقة الأخير حتى تصل إلى حالة الاستقرار، وتكون أيون الليثيوم الموجب (Li+).
- التوزيع الإلكتروني لذرة الكلور هو (Cl:2,8,7)، تميل إلى كسب إلكترون واحد حتى تصل إلى حالة الاستقرار، وتكون أيون الفلوريد السالب (Cl-).
تنشـأ بين الأيونين الموجب والسالب قوة تجاذب تسمى الرابطة الأيونية، وحتى تتساوى الشحنات الموجبة والسالبة، أي يبقى المجموع الجبري لشحنات المركب يساوي صفراً، فإن أيون الليثيوم (Li+) لا بد من أن يرتبط بأيون كلوريد (Cl-)، وتكون صيغة المركب الناتج (LiCl).
الأيون المتعدد الذرات: أيون مكون من نوعين أو أكثر من الذرات، يحمل شحنة سالبة أو موجبة.
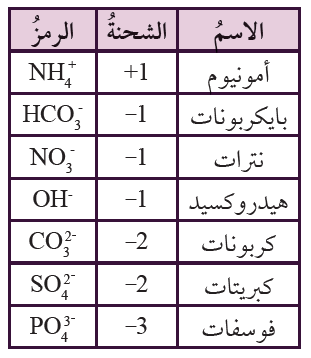
الصيغ الكيميائية للمركبات الأيونية
الصيغة الكيميائية: هي الصيغة التي تبين أنواع الذرات وعددها في المركب.
- الشحنة الكلية للمركب الأيوني تساوي صفر، لأن مجموع شحنات الأيونات الموجبة يساوي مجموع شحنات الأيونات السالبة، وبذلك يكون المركب الأيوني متعادلاً كهربائياً.
كيف نكتب الصيغ الكيميائية للمركبات الأيونية؟
* نحتاج إلى معرفة شحنة كل من الأيون الموجب والسالب في المركب.
مثال1:
أكتب الصيغة الكيميائية لمركب أكسيد الليثيوم.
الحل:
1. التوزيع الإلكتروني لذرة الأكسجين هو (O:2,6)
التوزيع الإلكتروني لذرة الليثيوم هو (Li:2,1)
2. اسم المركب: أكسيد الليثيوم
3. رمز الأيون: O-2 Li+
4. مقدار شحنة كل أيون 2 1

5. صيغة المركب: Li2O
مثال2:
أكتب الصيغة الكيميائية للمركب الناتج عن اتحاد المغنيسيوم مع أيون الهيدروكسيد.
الحل:
1. التوزيع الإلكتروني لذرة المغنيسيوم هو (Mg:2,8,2)
2. أحدد الأيون الموجب Mg+2
أحدد الأيون السالب OH-

4. صيغة المركب: Mg(OH)2
الرابطة التساهمية
الرابطة التساهمية: الرابطة الكيميائية التي تنشأ بين ذرتين من خلال التشارك في الكترونات التكافؤ للوصول إلى حالة الاستقرار.
مثال 1:
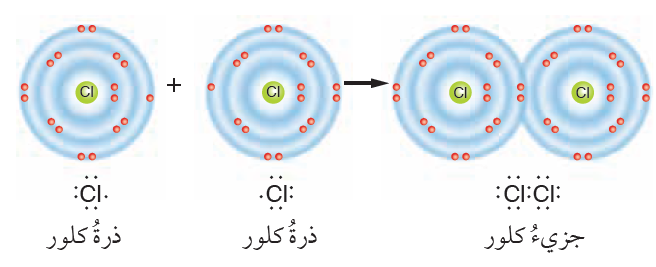
أوضح كيف تنشأ الرابطة التساهمية بين ذرتي كلور في جزيء Cl2.
الحل:
التوزيع الإلكتروني لذرة الكلور (Cl:2,8,7)
تحتاج ذرة الكلور إلى إلكترون واحد حتى تصل حالة الاستقرار، فترتبط برابطة تساهمية مع ذرة الكلور الأخرى كما في الشكل.
مثال 2:
أوضح كيف تنشأ الرابطة التساهمية في جزيء الماء H2O.
الحل:
التوزيع الإلكتروني لذرة الأكسجين (O:2,6)
التوزيع الإلكتروني لذرة الهيدروجين (H:1)
تحتاج ذرة الأكسجين إلى إلكترونين حتى تصل حالة الاستقرار، فترتبط برابطة تساهمية مع ذرتي هيدروجين حتى يصل الهيدروجين للاستقرار أيضاً.
الخصائصُ الفيزيائية للمركّباتِ الأيونية والمركّبات التساهمية
1 . درجات الانصهار والغليان: درجات غليان المركبات التساهمية وانصهارها منخفضة مقارنة بدرجات انصهار المركبات الأيونية وغليانها، وذلك لأن قوى التجاذب بين الجزيئات ضعيفة.
2 . التوصيل الكهربائي: توصل محاليل ومصاهير المركبات الأيونية التيار الكهربائي لاحتوائها على أيونات موجبة وسالبة، في حين أن غالبية المركبات التساهمية غير موصلة للتيار الكهربائي.
أتحقق: ما المقصود بالرابطة الأيونية؟ (صفحة 73)
الإجابة: هي رابطة تنشأ بين ذرتين احداهما تميل إلى فقد الإلكترونات، والأخرى تميل إلى كسبها.
أفكر: يرتبط المغنيسيوم Mg بالأكسجين O لتكوين مركب MgO ، فكيف يحدث ذلك؟ (صفحة 74)
الإجابة:
التوزيع الإلكتروني لذرة المغنيسيوم هو: (Mg: 2,8,2)
التوزيع الإلكتروني لذرة الأكسجين هو: (O: 2,6)
ألاحظ من التوزيع الإلكتروني أن ذرة المغنيسيوم تميل لفقد إلكترونين من الغلاف الأخير وتكون أيون ( 2+Mg)
بينما ذرة الأكسجين تميل لكسب إلكترونين حتى تصل إلى حالة الاستقرار وتكون أيون (2-O) وتنشأ بين الأيونين الموجب والسالب رابطة أيونية لينتج المركب الأيوني MgO
أفكر: يرتبط المغنيسيوم Ca بالأكسجين O لتكوين مركب CaO ، فكيف يحدث ذلك؟ (صفحة 75)
الإجابة:
التوزيع الإلكتروني لذرة المغنيسيوم هو: (Ca: 2,8,8,2)
التوزيع الإلكتروني لذرة الأكسجين هو: (O: 2,6)
ألاحظ من التوزيع الإلكتروني أن ذرة المغنيسيوم تميل لفقد إلكترونين من الغلاف الأخير وتكون أيون ( 2+Ca)
بينما ذرة الأكسجين تميل لكسب إلكترونين حتى تصل إلى حالة الاستقرار وتكون أيون (2-O) وتنشأ بين الأيونين الموجب والسالب رابطة أيونية لينتج المركب الأيوني CaO
أتحقق: ما المقصود بالأيون المتعدد الذرات؟ (صفحة 76)
الإجابة: هو أيون مكون من نوعين أو أكثر من الذرات، ويحمل شحنة سالبة أو موجبة
أفكر: يرتبط فلزُّ الألمنيوم بالبروم لتكوين مركب بروميد الألمنيوم، فما الصيغة الكيميائية لهذا المركب؟ (صفحة 76)
الإجابة: AlBr3
أفكر: ما صيغة المركب الناتج عن اتحاد الصوديوم مع أيون الكبريتات؟ (صفحة 78)
الإجابة: Na2SO4
أتحقق: أكتب الصيغة الكيميائية لمركب بايكربونات البوتاسيوم. (صفحة 78)
الإجابة: KHCO3
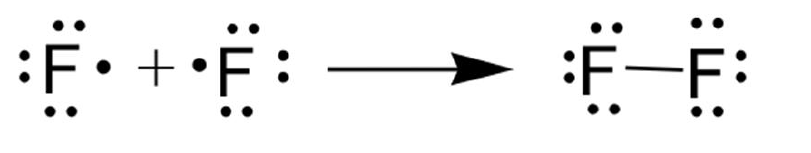
أتحقق: أوضح تكوين جزيء الفلور F2 باستخدام تركيب لويس. (صفحة 80)
الإجابة:
أتحقق: ما المقصود بالرابطة التساهمية؟ (صفحة 81)
الإجابة: هي رابطة تنشأ بين ذرات تميل للمشاركة بالإلكترونات حتى تصل الى حالة الاستقرار .
أفكر: أيُّهما أقوى الرابطة الأيونية في مركَّب أكسيد المغنيسيوم MgO أم كلوريد البوتاسيوم KCl ، علما أنَّ:(صفحة 82)
- درجة انصهار مركب أكسيد المغنيسيوم MgO تساوي 2852 oC .
- ودرجة انصهار مركب كلوريد البوتاسيوم KCl تساوي 770 oC
الإجابة: الرابطة الايونية في مركب MgO هي الأقوى
أتحقق: اذكر الخصائص العامة للمركبات التساهمية؟ (صفحة 82)
الإجابة:
1- المركبات التساهمية ذات درجات انصهار منخفضة
2- المركبات التساهمية ذات درجات غليان منخفضة
3 - المركبات التساهمية غير موصلة للتيار الكهربائي
تجربة صفحة (83) - الخصائص الفيزيائية للمركبات الأيونية والتساهمية
التحليل والاستنتاج :
1. أقارن: أيُّهما انصهر كلوريد الصوديوم أم السكر، ولماذا؟
السكر انصهر لأن الروابط تساهمية
2. أفسر: سبب إضاءة المصباح في إحدى الكؤوس وعدم إضاءتِه في الأخرى.
اضاءة المصباح بسبب وجود ايونات حرة الحركة في المركبات الايونية توصل التيار الكهربائي مثل مركب NaCl
عدم اضاءة المصباح بسبب عدم وجود ايونات كما في المركبات التساهمية مثل السكر.
3. أستنتج: أيُّهما موادُّ أيونية، وأيُّهما غير أيونية.
كلوريد الصوديوم (مادة أيونية) والسكر (مادة غير أيونية)