المفاهيم:
•القوى بين الجزيئات Intermolecular Forces : قوى تجاذب تنشأُ بين جُسيمات المادّة نفسِها، تختلفُ بطبيعتها عنِ الروابط الكيميائيّة التي تنشأُ بين الذرّات.
•الروابطُ الهيدروجينيّة Hydrogen Bonds : قوّةُ تجاذب تنشأُ بين جُزيئاتٍ تشاركُ فيها ذرّةُ الهيدروجين المرتبطة في الجُزيء برابطة تساهميّة معَ ذرّة أُخرى ذاتِ سالبيّة كهرَبائيّة عالية، مثل ذرّات .N, O, F
•قوى ثنائيّة القطب Dipole-Dipole : قوى تنشأُ بين جُزيئات قطبيّة نتيجة وجود الشحنات الجزئيّة السالبة والموجبة على هذه الجُزيئات.
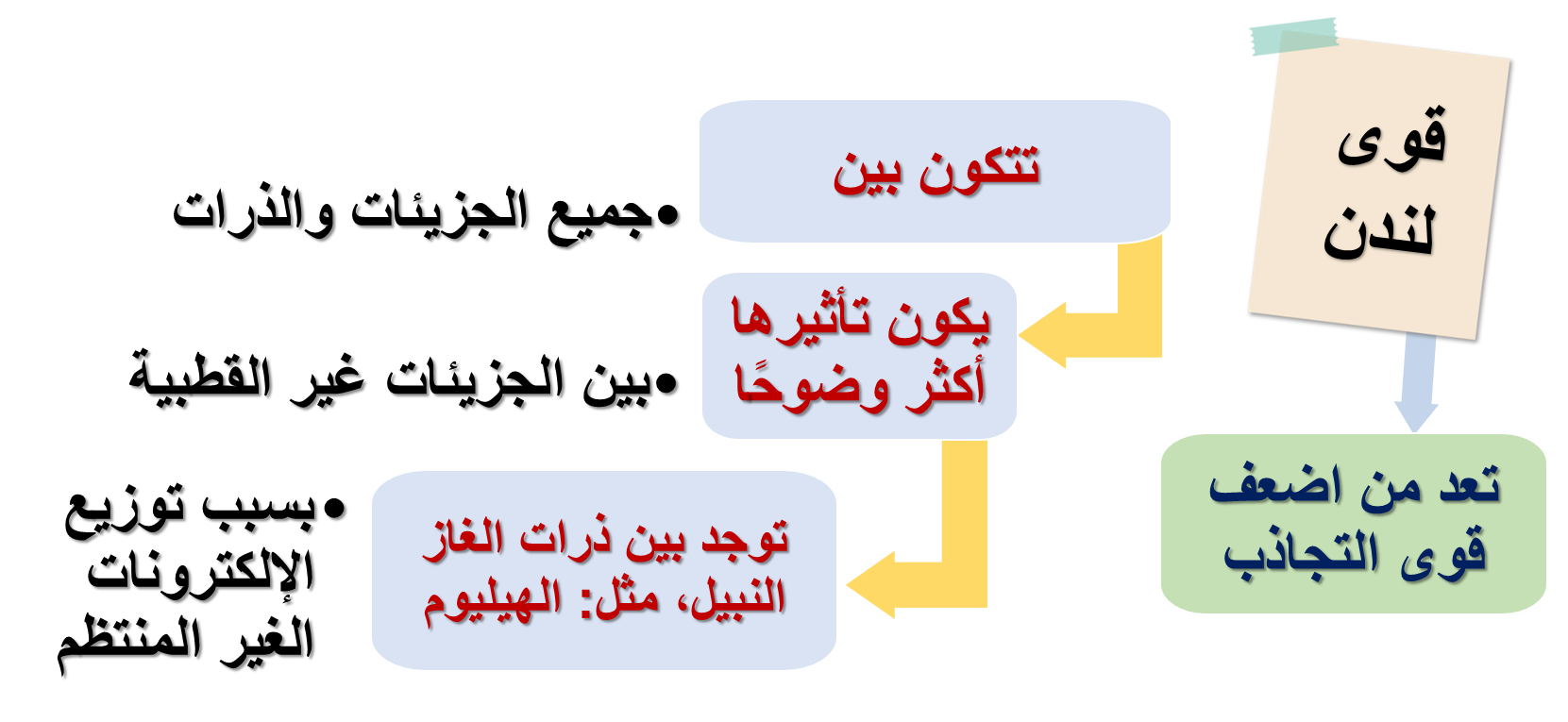
•قوى لندن London Forces : قوى تجاذب ضعيفةٌ تنشأُ نتيجة الاستقطاب اللحظيّ للجُزيئات أو الذرّات.
تقسم قوى التجاذب إلى ثلاثة أنواع أساسية:
1- الروابط الهيدروجينية: تنشأ الرابطة الهيدروجينية بين الجزيئات التي تحتوي على ذرة هيدروجين ترتبط في الجزيء برابطة تساهمية بإحدى الذرات ذات السالبة الكهربائية العالية. مثل: N , O , F
تعتمد قوة الرابطة الهيدروجينية على:
2- قوى ثنائية الأقطاب: تنشأ قوى ثنائية القطب نتيجة تجاذب بين الطرف السالب للجزيء والطرف الموجب لجزيء مجاور، حيث تتكون نتيجة ذلك شبكة من قوى التجاذب بين هذه الجزيئات.
قوى ثنائية القطب ⇔ تنشأ بين الجزيئات القطبيّة ⇔ يزداد تأثيرها بزيادة العزم القطبي للجزيء

3- قوى لندن: تنشأ قوى لندن نتيجة الاستقطاب اللحظي للجزيئات أو الذرّات، وهي قوى تجاذب ضعيفة.