المخاليط الحرارية والاتزان الحراري
هل تعرف والدتي قوانين الفيزياء؟
كيف عرفت والدتي أنه يجب ترك كأس يحوي منقوع النعنع فترة في الهواء حتى يبرد أو تضعه في المبرد إذا أرادت الإسراع في تبريده!
وكيف عرفت أنه لصهر كمية من السمن يمكنها وضع وعاء يحوي السمن في وعاء أكبر يحوي ماء ساخن!
وكيف عرفت أيضا أنه إذا كان هناك كأس يحوي ماء بارد جداً كانت تضيف إليه كمية من الماء الساخن ليصبح فاترا!
من الأمثلة السابقة يتضح أنه يحدث تبادل حراري بين الجسيمات المختلفة في درجة حرارتها، حيث تلقائيا تنتقل كمية حرارة من المادة
ذات الحرارة المرتفعة إلى المادة ذات الحرارة المنخفضة الملامسة لها.
المخلوط الحراري: اختلاط مادتين أو أكثر او تلامس جسمين مختلفين أو أكثر في درجة الحرارة، تفقد المادة ذات الحرارة العالية كمية من
الحرارة تساوي كمية الحرارة التي تكتسبها المادة ذات درجة الحرارة الأقل.
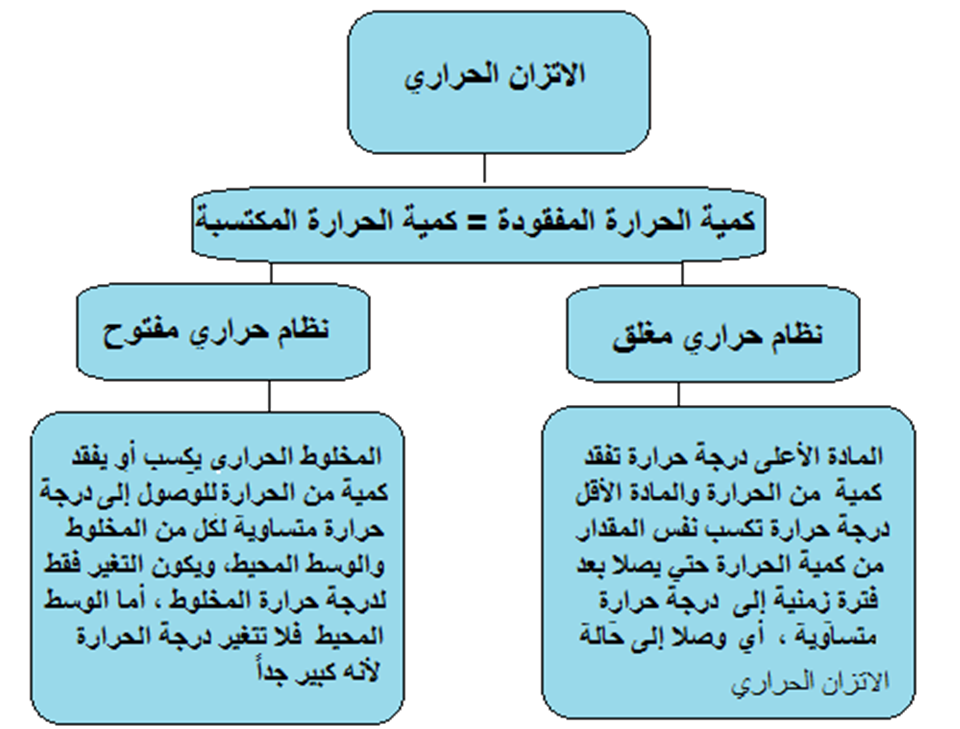
النظام الحراري المغلق: نظام حراري معزول عن الوسط المحيط بحيث لا يحدث تبادل حراري بين النظام والوسط المحيط.
النظام الحراري المفتوح: نظام حراري يسمح بتبادل الطاقة الحرارية بين مكونات المخلوط والوسط المحيط به.
مثال على نظام حراري مفتوح:
نظام حراري مفتوح
نظام حراري مفتوح يسمح بتبادل الطاقة الحرارية مع الوسط المحيط حيث تنخفض حرارة منقوع الشاي بعد فترة وهذا يعني
أنه حصل تبادل حراري مع المحيط ، فقد السائل كمية من الحرارة واكتسبها المحيط ولا أن المحيط لم تزيد درجة حرارته لأنه يعد مستودع
حراري كبير أي أنه يحتاج إلى كمية حرارة كبيرة جدا كي تزداد درجة حرارته أو أنه يفقد كمية حرارة كبيرة جداً كي تنخفض درجة حرارته.
مثال على نظام حراري مغلق:
الشكل: نظام حراري مغلق ( الثيرموس )
نظام حراري مغلق لا يسمح بتبادل الطاقة الحرارية مع الوسط المحيط لأن التيرموس المملوء بمنقوع الشاي معزول حراريا عن الوسط
المحيط فلا يحدث تبادل للطاقة الحرارية بين السائل ومنقوع الشاي.
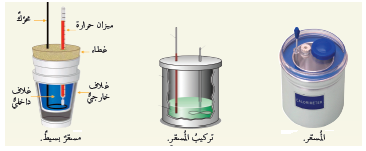
المسعر الحراري: إناء خاص معزول حراريا يتكون من إناءين من فلز كالنحاس أو الألمنيوم أحدهما داخل الآخر تفصل بينهما مادة عازلة للحرارة وللمسعر غطاء
فيه فتحتان أحدهما لإدخال ميزان حرارة والأخرى لإدخال أداة لتحريك الخليط ، يتم تبادل الطاقة الحرارية بين المواد المخلوطة داخل المسعر ويحدث
كذلك تبادل للطاقة مع الجدار الداخلي للمسعر بينما يقوم العازل والجدار الخارجي للمسعر بمنع انتقال الحرارة من المخلوط الحراري إلى الوسط المحيط
أو بالاتجاه المعاكس.
الشكل: المسعر الحراري
الاتزان الحراري
1- إذا كان النظام مفتوحا يحصل تبادل حراري بين المواد المخلوطة والوسط المحيط فهناك مواد تفقد كمية حرارة وتنخفض درجة حرارتها وهناك
مواد تكسب نفس كمية الحرارة وترتفع درجة حرارتها.
2- إذا كان النظام مغلقا فلا يحصل تبادل مع المحيط- بالرغم من أنه لا يوجد نظام مغلق بالكامل- فالتبادل يحصل بين المواد المخلوطة
فقط فمواد تفقد ومواد تكسب نفس الكمية من الحرارة بالتالي ويستمر انتقال الحرارة حتى تصل المواد المخلوطة أو المتلامسة أي
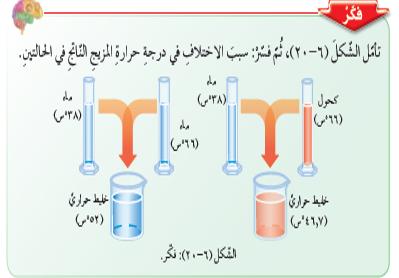
درجة الحرارة نفسها بعد مدة من الزمن وهذه الحالة تسمى ( الاتزان الحراري )، تأمل الشكل التالي:
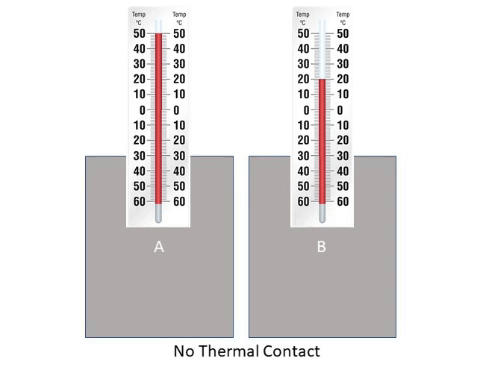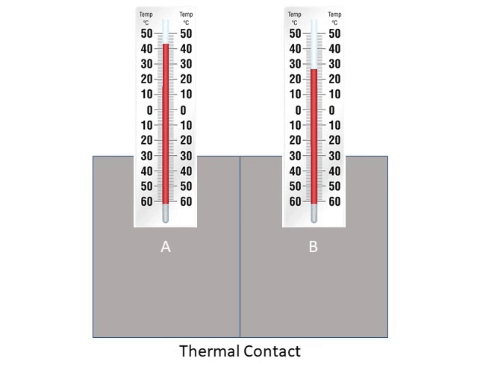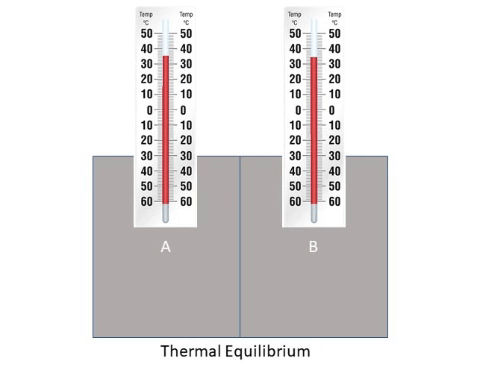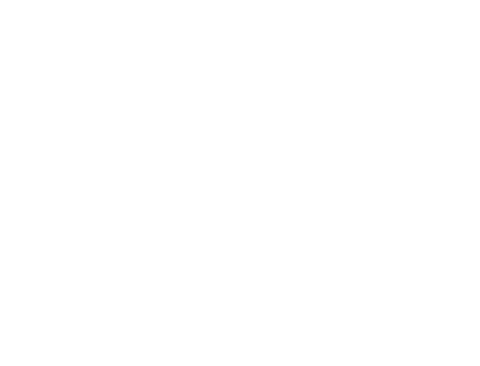 |
 |
والمخطط التالي يلخص الاتزان الحراري بين المواد في الأنظمة المختلفة المفتوحة والمغلقة وما يجمع بينها هو أن:
كمية الحرارة المفقودة تساوي كمية الحرارة المكتسبة حتى تصبح درجة حرارة المواد متساوية.
مثال 1
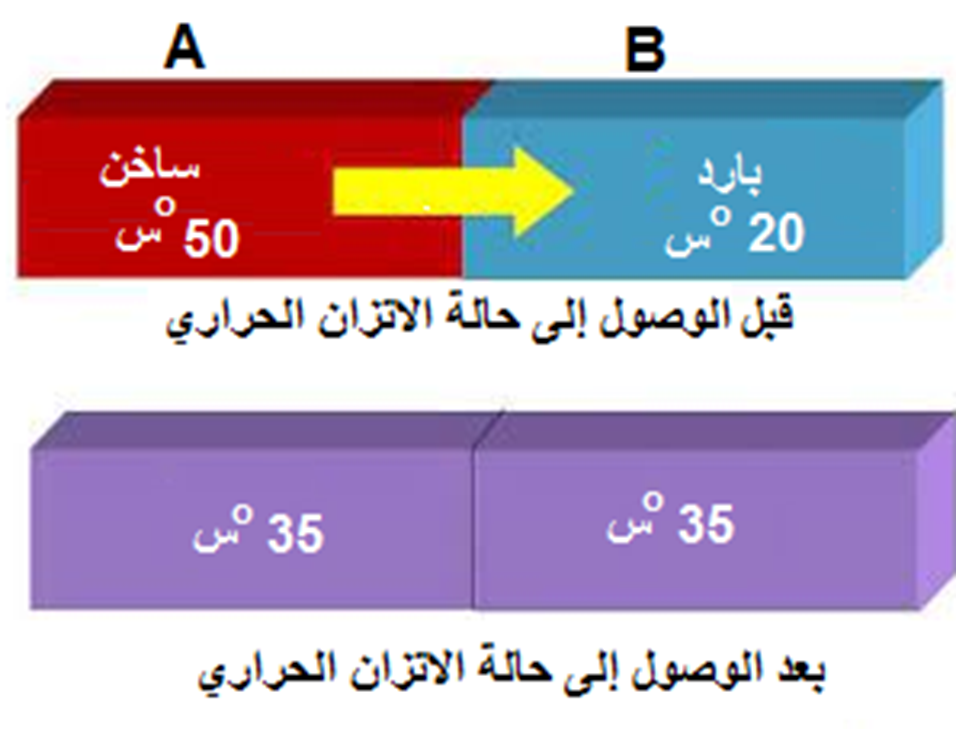
لاحظ الشكل -جهة اليسار- لو جمعنا درجة حرارة الماء في الوعاءين وأوجدنا المتوسط سيكون .
ولكن على اليمين هناك مادتان مختلفتان، فدرجة حرارة المخلوط تعتمد على كتلة الكميات المختلطة ونوعها ودرجة حرارتها.
في اي تبادل حراري تلقائي تكون وحسب قانون حفظ الطاقة:
1- كمية الحرارة المكتسبة = -(كمية الحرارة المفقودة)
ك1× ح1 ن × د = - ك2×ح2ن × د
انتبه هنا لإشارة السالب: حيث أنه عند خلط مادتين فأحدهما يكسب كمية حرارة والآخر يخسر نفس الكمية فأحدهما تزداد
طاقته الحرارية والآخر تقل.والمادة التي تكسب هي المادة التي ترتفع درجة حرارتها والمادة التي تخسر هي التي تنخفض درجة حرارتها.
2- تكون درجة حرارة المخلوط والمحيط متساوية بعد الاتزان الحراري اذا كان نظاما مفتوحا وتكون درجة حرارة المواد المخلوطة والجدار الداخلي للمسعر
متساوية في حالة النظام المغلق.
ملاحظة مهمة : هذه الاشارة تلفظ دلتا وتعني (القيمة النهائية - القيمة الابتدائية ) بغض النظر أيهما أكبر.
قبل أن نبدأ بحل أسئلة أود ان أتأكد من معرفتك بعمليات التحويل بين الوحدات وسنتعرف على طريقة استخدام معامل التحويل.
مثال 2:
نعلم ان:

( )
لو أردنا تحويل 40 سم إلى وحدة م :
مثال 3: 5 م = 5×100 = 500 سم
نعلم ايضا ان :
مثال 4: أ. حول 200 غم الى وحدة كغ:
ب. حول 5 غم إلى وحدة كغ:
مثال 5:
سنحول 2.5 دقيقة الى وحدة ثانية:
مثال 6: نظام حراري مغلق مكون من مسعر نحاسي فيه 150 غم ماء درجة حرارته ، أضيف اليه 100 غم ماء ساخن درجة حرارته ،
مهملا تأثير المسعر في الاتزان الحراري، احسب درجة الحراة النهائية للمزيج.
الحل :
إنتبه لقد اضفنا ماء ساخن حرارته النوعية تساوي الحرارة النوعية للماء البارد وحدث إتزان حراري بينهما و الجدار الداخلي للمسعر ولكن في السؤال
طلب منا ان نهمل تأثير المسعر ، بالتالي الاتزان حصل بين الماء البارد والماء الساخن.
أنتبه ايضا ان الكتل بوحدة غ فيجب تحويلها الى وحدة كغ كما تعلمنا.
كمية الحرارة المكتسبة للماء البارد = - كمية الحرارة المفقودة من الماء الساخن
= -()
=
بالقسمة على : (انتبه هنا ان في الطرفين لنفس المادة وهي الماء وهذا ما يسمح لنا بالقسمة عليها للتخلص منها في الطرفين)
= -
=
مثال 7 : كمية من الماء كتلتها ودرجة حرارتها ، وضعت في مسعر من الالممنيوم معزول درجة حرارته من الداخل ، فاتزن النظام عند درجة حرارة .
احسب:
1- كمية الحرارة التي فقدها الماء.
2- كتلة الاناء الداخلي للمسعر.
الحل: 1- كمية الحرارة التي فقدها الماء= ك ماء × ح ن ماء× د
= 0.075 × 4200× ( 64 - 72) = - 2520 جول.
2- الحرارة النوعية للالمنيوم وللماء أجدها في الجدول (6-2)صفحة 46 ( ح ن = 900جول/ كغ .ْ س).
عند الاتزان الحراري :
كمية الحرارة المكتسبة من الالمنيوم = - (كمية الحرارة المفقودة من الماء )
= - (-2520 )
= 2520
المثال 8: مسعر معزول فيه كمية من الماء كتلتها ودرجة حرارتها ، وضعت فيه قطعة ساخنة من النحاس كتلتها 50 غ ،
فاتزن النظام عند درجة حرارة ، مهملا تأثير المسعر احسب درجة حرارة قطعة النحاس قبل تبريدها.
الحل:
عند الاتزان الحراري الماء يكتسب لأن درجة حرارته تأولى اقل من درجة حرارة الاتزان والنحاس يفقد
كمية الحرارة المكتسبة من الماء = - كمية الحرارة المفقودة من النحاس
= - ()
= -
6300 = 20 د - 720
|
تطبيقات الاتزان الحراري: الشكل يبين ميزان حرارة زئبقي وكحولي 1- مستودع الميزان يتكون من زجاج جداره رقيق جدا. 2- كمية الزئبق أو الكحول داخل الميزان قليلة 3- قطر الأنبوب الداخلي شعريا (رفيع جدا) 4-وجود اختناق فوق المستودع. فلماذا تم تصميمهما بهذا الشكل؟ |
 ميزان حرارة كحول وميزان زئبقي ميزان حرارة كحول وميزان زئبقي |
في ميزان الحرارة الزئبقي والكحولي يكون:
1- جدار المستودع رقيقًا حتى يحدث الاتزان الحراري( التبادل الحراري ) بين الزئبق أو الكحول والوسط بسرعة.
2- كمية الزئبق أو الكحول القليلة حتى تتزن مع الوسط بانتقال كمية قليلة من الحرارة، دون أن يؤثر ذلك على درجة حرارة الوسط التي سيقيسها الميزان.
3-كلما كان قطر الأنبوب الشعري صغيرا، زاد معدل الارتفاع في مستوى الزئبق أو الكحول، مهما كان الاختلاف في درجات الحرارة والتمدد صغيرين.
4- هناك اختناق في أسفل الأنبوب وذلك ليمنع رجوع الزئبق أو الكحول للمستودع مباشرة ، فيتمكن الشخص من قراءة تدريج الميزان.