المواد النقية والمخاليط
|
أستكشف: كيف تختلط المواد مع الماء لتكوين المخاليط؟ خطوات العمل: 2- أقيس: أستعمل المخبار المدرج الذي سعته ( 150ml)، لأضع (100ml )من الماء في كل كأس من الكؤوس الزجاجية الثماني. 3- أجرب: أضيف ملعقة ملح إلى الكأس رقم (1)، وملعقة رمل إلى الكأس رقم (2)، وملعقة سكر إلى الكأس رقم (3)، وملعقة برادة حديد إلى الكأس رقم (4)، ثم أحركها جميعها جيدا، وأنتظر مدة 10min. 4- أجرب: باستخدام المخابير المدرجة التي سعتها ( 100ml)، أضيف (50ml ) من الزيت إلى الكأس رقم (5)، و ( 50ml) من الكحول الطبي إلى الكأس رقم (6)، و( 50ml) من الخل إلى الكأس رقم (7)، و( 50ml) من الفازلين السائل إلى الكأس رقم ( 8)، ثم أحركها جميعها، وأنتظر مدة 10min. 5- ألاحظ: ما الذي يحدث للمواد في كل كأس؟
(1)، و(3): سيختلط الملح والسكر ويمتزجان بالماء بشكل متجانس، ويذوبا فيه، ويكونا مخلوطًا متجانسًا (محلولًا). (2)، و(4): سيختلط كل من الرمل وبرادة الحديد مع الماء بحيث يكوّن كل منهما مخلوطًا غير متجانس، ثم يترسبا في قاع الكأس. (5) و(8): سيختلط كل من الزيت والفازلين السائل مع الماء بحيث يكوّن كل منهما مخلوطًا غير متجانس، ثم يطفوان على سطح الماء في الكأس. (6)، و(7): سيختلط الكحول والخل ويمتزجان بالماء بشكل متجانس، ويذوبا فيه، ويكونا مخلوطًا متجانسًا (محلولًا) 6- أحدد المخاليط في الكؤوس المرقمة من (1) إلى (8) التي تعد سائلا مع سائل، والمخاليط التي تعد صلبا مع سائل، ثم أدون ملاحظاتي.
سائل مع سائل: المخاليط الموجودة في الكؤوس من (5) إلى (8). صلب مع سائل: المخاليط الموجودة في الكؤوس من (1) إلى (4). 7- أصنف أي المواد امتزجت مع الماء، وأيها لم تمتزج؟
المواد التي امتزجت: الملح، والسكر، والكحول، والخل. المواد التي لم تمتزج: الرمل، وبرادة الحديد، والزيت، والفازلين. 8- أنظم بياناتي: أنشئ جدولا مكونا من أربعة أعمدة، بحيث يحمل العمود الأول العنوان " سائل مع سائل"، والعمود الثاني " سائل مع صلب"، والعمود الثالث " امتزجت" والعمود الرابع " لم تمتزج".
9- أتواصل: أشارك زملائي/ زميلاتي فيما توصلت إليه. |
المواد النقية
تختلف المواد عن بعضها البعض، ومن الأمثلة على المواد: الماء، الملح، السكر، غاز ثاني أكسيد الكربون.
ويمكن وصف كل مادة من هذه المواد بأنها مادة نقية.
المادة النقية هي: مادة كيميائية لها تركيب محدد وثابت، وخصائص كيميائية لا تتغير.
مثل: النحاس، الحديد، الألماس، الذهب.

أتحقق: أعرف المادة النقية، وأذكر أمثلة عليها.
المادة النقية: هي مادة كيميائية لها تركيب محدد وثابت، وخصائص كيميائية لا تتغير.
أمثلة: الفضة Ag، والزئبق Hg، والكبريت S.
المخاليط
المخلوط هو ناتج اختلاط مادتين نقيتين أو أكثر معا بطرائق وكميات مختلفة.
أمثلة على المخاليط:
- الخرسانة، هي مزيج من الحصى والرمل والاسمنت والماء، تخلط معا بكميات محددة، وتستخدم في تشييد الأبنية والجسور المختلفة.

- سوائل التنظيف
- الدهانات
- مخلوط المكسرات
- سلطة الخضراوات
- سلطة الفواكه
- مساحيق التجميل
أتحقق: أوضح المقصود بالمخلوط، وأذكر أمثلة على المخاليط.
هو ما ينتج من اختلاط مادتين نقيتين أو أكثر معا بطرائق وكميات مختلفة، مثل الحمص والعدس، والحساء، والألوان المختلفة.
|
أتامل الصورة أتوقع: بماذا قد يختلف مخلوط سلطة الخضراوات الظاهر في الصورة عن مخلوط سلطة آخر؟
قد يختلف مخلوط سلطة الخضراوات الظاهر في الصورة عن مخلوط سلطة آخر في أنواع مكوناته، وحجمها، وطرائق اختلاطها، فكل مخلوط سلطة يتميز بمكوناته الخاصة به. |
المخاليط غير المتجانسة
تتكون المخاليط غير المتجانسة عند خلط مادتين نقيتين أو أكثر ولا تمنزج معا، بحيث يمكن تمييزها، وفصل بعضها عن بعض بطرائق بسيطة.
أمثلة: مخلوط الرمل والماء، مخلوط الزيت والماء، مخلوط الكبريت وبرادة الحديد.

المخاليط المتجانسة (المحلول)
تتكون المخاليط المتجانسة عند خلط مادتين نقيتين أو أكثر وتمتزج معا، بحيث لا يمكن تمييزها، ويصعب فصل بعضها عن بعض.
أمثلة: العطور، الماء المالح.

يتكون المحلول من مذيب ومذاب،
المذاب Solute: هو المادة الصلبة أو السائلة أو الغازية التي تذوب.
المذيب Solvent: المادة التي يذوب فيها المذاب.
ومن أشهر الأمثلة على المذيبات: الماء.
أتحقق: أقارن بين المخلوط غير المتجانس والمخلوط المتجانس.
المخلوط غير المتجانس هو الذي ينتج عن اختلاط مادتين أو أكثر ولا تمتزج معا، ويمكن تمييزها وفصل بعضها عن بعض، أما المخلوط المتجانس فهو الذي ينتج عن اختلاط مادتين أو أكثر وتمتزج معا ولا يمكن تمييزها وفصل بعضها عن بعض.
تصنف المحاليل حسب حالة المذيب إلى: محاليل سائلة، محاليل صلبة، محاليل غازية.
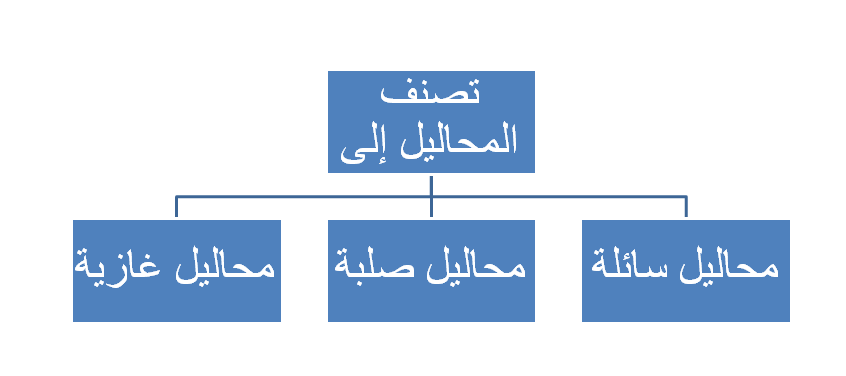
أنواع المحاليل السائلة
تصنف المحاليل السائلة إلى: (محلول صلب - سائل)، (محلول سائل - سائل)، (محلول غاز - سائل).
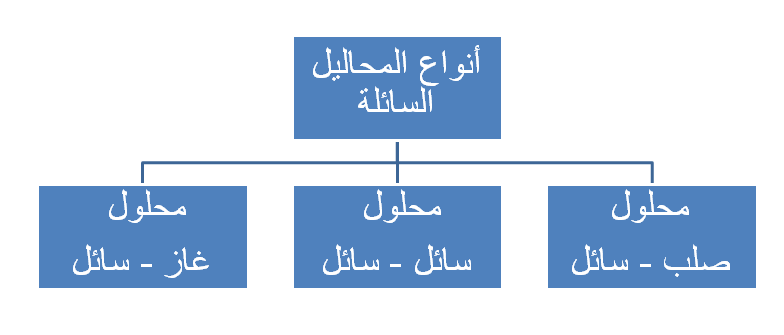
محلول صلب _ سائل
هو محلول ينتج من خلط مادة مذابة صلبة مع مادة مذيبة سائلة، فعند وضع ملعقة سكر صغيرة (مذاب) في كأس تحتوي على ماء (مذيب) وتحريكها، سيذوب السكر ويختلط بالماء، فالسكر والماء لم يتغير تركيبهما، إنما اختلطا وامتزجا معا.

محلول سائل - سائل
هو محلول ينتج من خلط مادة مذابة سائلة مع مادة مذيبة سائلة، بحيث تمتزجان معا وتكونان محلولا، فعند خلط كمية من الكحول (مذاب) مع كمية من الماء (مذيب)، سوف يمتزجان معا ويكونان محلولا.
من الأمثلة على محلول سائل _ سائل:
معقمات الأيدي

الشراب المركز عند تخفيفه بالماء

محلول غاز - سائل
هو محلول ينتج من خلط مادة مذابة غازية مع مادة مذيبة سائلة، بحيث تمتزجان معا وتكونا محلولا.
مثال: عندما يختلط غاز الأكسجين (مذاب) مع الماء (مذيب)، سوف يمتزجان معا ويكونا محلولا، ومثال عليه (خلط غاز ثاني أكسيد الكربون مع الماء في المشروبات الغازية).

أتحقق: أميز بين كل من المحاليل الآتية: صلب - سائل، وسائل - سائل، وغاز - سائل.
محلول صلب - سائل: هو الذي ينتج من خلط مادة مذابة صلبة مع مادة مذيبة سائلة.
محلول سائل - سائل: هو الذي ينتج من خلط مادة مذابة سائلة مع مادة مذيبة سائلة.
محلول غاز - سائل: هو الذي ينتج من خلط مادة مذابة غازية مع مادة مذيبة سائلة.
وتصنف المحاليل بحسب كمية المادة المذابة إلى:
المحلول غير المشبع
محلول غير مشبع Unsaturated Solution هو محلول يحتوي على كمية قليلة من المذاب، ويمكن إذابة المزيد من المادة المذابة فيه.
فعند إذابة ملعقة واحدة صغيرة من السكر في كأس مليئة بالماء وتحريكها سيذوب السكر، ونحصل على محلول تكون كمية السكر الذائبة فيه قليلة، ويكون مذاقه حلوا بدرجة قليلة، وطالما أن أي كمية تضاف من السكر إلى الماء تذوب فيه فإن هذا المحلول يوصف بأنه محلول غير مشبع، ومع إذابة المزيد من السكر في الماء ستزداد كمية السكر الذائبة فيه ونحصل على محلول يكون مذاقه أكثر حلاوة.

المحلول المشبع Saturated Solution
محلول مشبع: هو محلول يحتوي على كمية مناسبة من المذاب، ولا يمكن إذابة أي كمية من المادة المذابة فيه.
مع الاستمرار في إضافة المزيد من السكر إلى الكأس المليئة بالماء والتحريك، فعند حد معين لا يذوب السكر في الماء، لأن الماء أذاب أكبر كمية منه، ولا يمكنه إذابة أي كمية أخرى، فإذا استمررت في إضافة السكر إلى الماء ستبدأ حبيباته بالترسيب في قاع الكأس، ولن تذوب حتى لو استمررت في عملية التحريك، وهنا يوصف المحلول بأنه مشبع لأنه أصبح يحتوي على أكبر كمية من السكر يمكن إذابتها فيه.

أتحقق: أقارن بين المحلولين: المشبع وغير المشبع.
المحلول غير المشبع هو الذي يمكن أن تذوب فيه أي كمية من المادة المذابة التي تضاف إليه.
المحلول المشبع هو الذي أصبح يحتوي على أكبر كمية من المادة المذابة التي يمكن إذابتها فيه، ولا يمكن أن تذوب فيه أي كمية مضافة إليه حتى مع التحريك.
|
أتأمل الصورة أفسر: ما سبب ترسب حبيبات الملح عند محاولة إذابتها في المحلول الملحي الظاهر في الشكل، رغم الاستمرار في تحريكه؟
لأن المحلول أصبح يحتوي على أكبر كمية من الملح التي يمكن إذابتها فيه، ولا يمكن أن تذوب فيه أي كمية مضافة إليه حتى مع التحريك. |
|
نشاط: تحضير محلول سكر مشبع ملاحظة: أتبع إرشادات معلمي/ معلمتي لاستخدام الميزان الإلكتروني والمخبار المدرج بالطريقة الصحيحة. المواد والأدوات: كأس زجاجية شفافة سعتها (150ml )، ماء في درجة حرارة الغرفة، سكر، ملعقة صغيرة، ميزان إلكتروني، مخبار مدرج سعته ( 150ml). خطوات العمل: 1- أقيس ( 100ml) من الماء باستخدام المخبار المدرج، وأضعها في الكأس الزجاجية الشفافة. 2- أقيس كمية من السكر كتلتها ( 5g) باستخدام الميزان الالكتروني. 3- أجرب: أضيف كمية السكر التي قستها تدريجيا إلى الماء في الكأس الزجاجية، وأحرك بالملعقة إلى أن يذوب السكر تماما، ويصبح المحلول صافيا. 4- أكرر الخطوتين (2)، و (3) إلى أن يتوقف ذوبان السكر، ويبدأ بالترسب في قاع الكأس الزجاجية. 5- ألاحظ: أدون ملاحظاتي بعد إضافة كل (5g ) من السكر. ستذوب كميات السكر المضافة إلى كأس الماء، إلى أن أصل إلى حد معين لا تذوب فيه كمية السكر التي أضفتها. 6- أحسب: ما مقدار كمية السكر التي ذابت في الماء تماما؟ ستختلف الإجابات بحسب درجة حرارة الماء، ودقة القياسات، وستتراوح القيمة بين 20g إلى 25g من السكر ستذوب في 100ml من الماء عند درجة حرارة الغرفة. 7- أستنتج: لماذا لا يمكنني رؤية حبيبات السكر بعد ذوبانها في الماء؟ لأن حبيبات السكر سوف تختلط بالماء، وتمتزج به بشكل متجانس. 8- أصنف: ما نوع المحلول الذي حصلت عليه بعد ترسب السكر؟ محلول مشبع 9- أتواصل: أشارك زملائي/ زميلاتي في ما توصلت إليه. |
التركيز
التركيز :هو نسبة كتلة المادة المذابة إلى حجم المذيب.
عند إضافة بضع قطرات من إحدى صبغات الطعام في عبوة مليئة بالماء ورجها، ستذوب صبغة الطعام ويتكون محلول تكون كمية صبغة الطعام التي ذابت فيه قليلة، ويكون لونه فاتحا،

ولكن مع إذابة المزيد من صبغة الطعام ستزداد كمية الصبغة الملونة الذائبة، ويصبح لون المحلول غامقا، عندها يكون تركيز المحلول قد ازداد.

أتحقق: أوضح المقصود بالتركيز.
هو نسبة كتلة المادة المذابة إلى حجم المذيب.
|
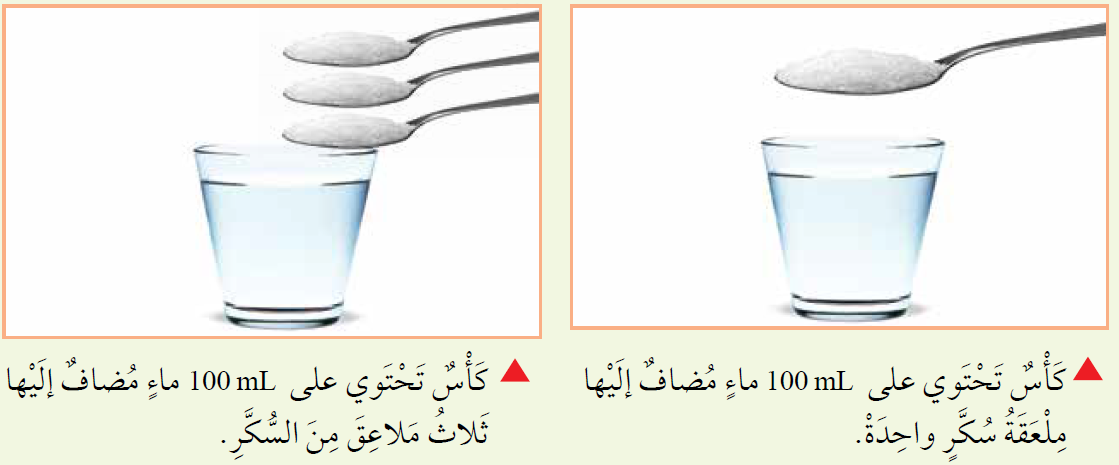
أتأمل الصورتين أتوقع: أي المحلولين تركيزه أكبر؟ أفسر إجابتي.
المحلول الذي في الكأس التي تحتوي على ثلاث ملاعق من السكر تركيزه أكبر، لأن نسبة كتلة السكر إلى حجم الماء أكبر من الكأس التي تحتوي على ملعقة واحدة من السكر. |