المحتوى الحراري (Enthalpy)
- تعريفه : هو كمية الطاقة المخزونة في مول من المادة ويرمز له بالرمز H
- يطلق على كمية الطاقة الممتصة أو المنبعثة خلال التفاعل بـ (التغير في المحتوى الحراري )
- تكون إشارة ΔH (+) موجبة إذا كانت الطاقة منبعثة
- تكون إشارة ΔH (-) سالبة إذا كانت الطاقة ممتصة
ملاحظة : يعتمد التغير في المحتوى الحراري (ΔH) على الحالة النهائية والحالة البدائية للتفاعل ولا يعتمد التغير في المحتوى الحراري (ΔH) على الطريقة التي يحدث بها التفاعل .
- التغير في المحتوى الحراري يمثل الفرق بين المحتوى الحراري للمواد الناتجة (HPr) والمحتوى الحراري للمواد المتفاعلة (Hre).
- يمكن حساب التغير في المحتوى الحراري بإستخدام العلاقة الأتية :
-
التغير في المحتوى الحراري = المحتوى الحراري للمواد الناتجة – التغير في المحتوى الحراري للمواد المتفاعلة
بالرموز :
- تفاعلات طاردة للحرارة ( Exothermic Reaction)
- يكون التغير في المحتوى الحراري للتفاعل (ΔH) (-) سالب
- حيث يكون : المحتوى الحراري للمواد الناتجة (HPr) أقل من المحتوى الحراري للمواد المتفاعلة (Hre)
- يستفاد من الحرارة (Heat) المنبعثة من التفاعلات الطاردة للطاقة في مختلف مناحي الحياة مثل :
أ) عمليات طهو الطعام ب) التسخين جـ) تشغيل المركبات والآلات الصناعية
- تفاعلات ماصة للحرارة ( Endothermic Reaction)
- يكون التغير في المحتوى الحراري للتفاعل (ΔH) (+) موجب
- حيث يكون : المحتوى الحراري للمواد الناتجة (HPr) أكبر من المحتوى الحراري للمواد المتفاعلة (Hre)
- تحتاج بعض التفاعلات إلى كمية من الطاقة للتغلب على الروابط بين ذرات المواد المتفاعلة، فتمتص هذه المواد الطاقة من الوسط المحيط مما يسبب إنخفاضًا في درجة حرارة الوسط .
التجربة (1) : التفاعل الطارد والتفاعل الماص للطاقة
- الهدف من التجربة : تمييز التفاعلات الطاردة والماصة للطاقة
- الطاقة والحالة الفيزيائية للمادة : ( Energy and Physical State of Matter)
- توجد المادة في حالات فيزيائية ثلاث وهي :
أ) الحالة الصلبة ب) الحالة السائلة جـ) الحالة الغازية
- كل حالة من الحالات الفيزيائية للمادة لها خصائص معينة تعتمد على طبيعة المادة والروابط بين جسيماتها.
- من الممكن أن تتحول المادة من الحالة الفيزيائية إلى حالة أخرى مثلاً:
أ) من الممكن أن تتحول الغازات إلى سوائل بالضغط والتبريد
ب) من الممكن تحويل المادة الصلبة إلى سائلة بالتسخين
- يشير هذا إلى أنه يرافق تحول المادة من الحالة فيزيائية إلى أخرى تغيرات في الطاقة وقد يكون هذا التحول ماصًا للطاقة أو طاردًا لها، والشكل الأتي يمثل تغيرات الطاقة المصاحبة للتحولات الفيزيائية للمادة :
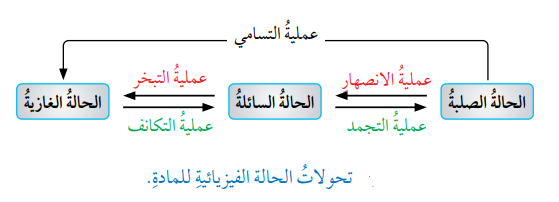
- الإنصهار : (Fusion)
- تعريفه : هو عملية تحول المادة من الحالة الصلبة إلى الحالة السائلة .
- متطلباته : تزويد المادة بكمية كافية من الطاقة الحرارية، للتغلب على الترابط بين جزيئات المادة أو ذراتها.
- نوع العملية : الإنصهار هو عملية ماصة للطاقة.
- التبخر : (Evaporation)
- تعريفه : هو عملية تحول المادة من الحالة السائلة إلى الحالة الغازية، حيث تصبح جزيئات المادة أو ذراتها أكثر قدرة على الحركة
- متطلباته : تزويد المادة بكمية من الطاقة الحرارية التي تعمل على تحرير الجزيئات أو الذرات من قوى الترابط بينها في الحالة السائلة.
- نوع العملية : التبخر هو عملية ماصة للطاقة؛ حيث تستمد المادة الطاقة اللازمة من الوسط المحيط بها
- التجمد : (Freezing)
- تعريفه : هو عملية تحول المادة من الحالة السائلة إلى الحالة الصلبة؛ مما يقلل من حرية حركة الجزيئات أو الذرات، ويزيد من تجاذبها وتماسكها، وهذا يتم من خلال تبريد المادة بواسطة خفض درجة حرارتها.
- متطلباته : فقدان المادة إلى كمية من الطاقة
- نوع العملية : التجمد هو عملية طاردة للطاقة
- ملاحظة : كمية الطاقة الناتجة من تجمد مول من المادة عند درجة حرارة معينة تساوي الطاقة اللازمة لصهرها عند درجة الحرارة نفسها .
- التكاثف : (Condensation)
- تعريفه : هو عملية تحول المادة من الحالة الغازية إلى الحالة السائلة؛ عند زيادة الضغط المؤثر عليه وخفض درجة حرارته، مما يتيح تقارب جزيئات الغاز من بعضها بالقدر الذي يسمح بتجاذبها وتحولها لسائل
- متطلباته : فقدان المادة إلى كمية من الطاقة
- نوع العملية : التكاثف هو عملية طاردة للطاقة.
- تسمى كمية الطاقة المنبعثة عند تكاثف مول من الغاز عند درجة الغليان بــ : ( طاقة التكاثف المولية ) (Molar Condensation Energy)
- ملاحظة : إن طاقة التكاثف المولية تساوي طاقة التبخر المولية.
- التسامي : (Sublimation)
- تعريفه : هو عملية تحول المادة من الحالة الصلبة إلى الحالة الغازية دون المرور بالحالة السائلة .
- متطلباته : تزويد المادة بالطاقة اللازمة لتكسير الروابط بين جزيئاتها أو ذراتها، ويصبح التجاذب بينها ضعيفًا جدًا فتتحول للحالة الغازية.
- نوع العملية : التكاثف هو عملية ماصة للطاقة.