- تفاعل التعادل : ( Neutralization Reaction)
- تعريفه : هو التفاعل بين محلول الحمض ومحلول القاعدة.
- تشترك غالبية الحموض بوجود ذرات الهيدروجين في تركيبها وينتج عن ذوبانها في الماء أيونات الهيدروجين +H
- يشترك عدد من القواعد في وجود مجموعة الهيدروكسيد -OH في تركيبها، وينتج عن ذوبانها في الماء أيونات الهيدروكسيد -OH
- تكون المعادلة النهائية من تفاعل أيونات الهيدروجين +H من الحمض وأيونات الهيدروكسيد -OH من القاعدة لتكوين جزيئات الماء، كما في المعادلة الآتية :
- المعادلة الأيونية : ( Ionic Equation)
- تعريفها : هي المعادلة التي تتضمن الأيونات الموجودة في المحلول المائي .
- تعريف الأيونات المتفرجة : هي الأيونات التي لم تشترك في التفاعل ولم تتغير شحناتها ولهذا يمكن حذفها من طرفي المعادلة
- تعريف المعادلة الأيونية النهائية : هي المعادلة التي تصف الأيونات المتفاعلة في المحلول المائي .
- بهذا تكون المعادلة النهائية أيونات الهيدروجين +H من الحمض وأيونات الهيدروكسيد-OH من القاعدة لتكوين جزيئات الماء كما يأتي :
- الأملاح : ( Salts)
- تعريف الملح : هو مركب أيوني ينتج من تفاعل محلول الحمض مع محلول قاعدة، ويوجد عادةً على شكل بلورات صلبة .
- تتألف صيغة الملح من من جزئين هما الأيون الموجب من القاعدة والأيون السالب من الحمض.
- يوضح الجدول الآتي أمثلة لبعض الحموض وأيوناتها السالبة وإسم الملح المتكون منها وصيغته :
| الحمض | الأيون السالب من الحمض | اسم الملح المتكون |
| الهيدروكلوريك HCl | -Cl | كلوريد البوتاسيومKCl |
| النيتريك HNO3 | -NO3 | نترات الصوديوم NaNO3 |
| الكبريتيك H2SO4 | 2-SO4 | كبريتات المغنيسبيوم MgSO4 |
|
الفسفوريك H3PO4 |
3-PO4 |
فسفات الكالسيوم Ca3(PO4)2 |
- تحضير الأملاح : (Preparation Salts)
- يمكن الحصول على الأملاح في المختبر بعدة طرائق، منها تفاعل الحموض مع القواعد أو القلويات فمثلًا:
- يمكن الحصول على ملح كلوريد البوتاسيوم KCl من تفاعل محلول حمض الهيدروكلوريك HCl مع محلول هيدروكسيد البوتاسيومKOH
- يمكن الحصول على ملح كبريتات النحاس CuSO4 من تفاعل حمض الكبريتيك مع أكسيد النحاس CuO
- تتفاعل الحموض مع الفلزات وينتج عنها ملح الفلز ويتصاعد غاز الهيدروجين.
- يتفاعل حمض HCl مع فلز المغنيسيوم Mg وينتج ملح كلوريد المغنيسيوم MgCl2
- تفاعل الحموض مع كربونات الفلز كما في تفاعل حمض النيتريك مع كربونات النحاس فتنتج نترات النحاس والماء وغاز ثاني أكسيد الكربون .
- تفاعل الحموض مع القواعد التي لا تحتوي على أيون الهيدروكسيد OH- في تركيبها وينتج الملح
- ملح كلوريد الأمونيوم NH4Cl الذي ينتج من تفاعل حمض HCl مع الأمونيا NH3
- عند خلط محلولين لملحين مختلفين؛ ينتج عنهما ملحان آخران كما يحدث عند خلط محلولي الملحين كربونات البوتاسيوم K2CO3 وكلوريد الخارصين ZnCl2 فينتج محلول كلوريد البوتاسيوم ويترسب ملح كربونات الخارصين
- تصنيف الأملاح : (Classification Salts)
- تصنف محاليل الأملاح إلى : (حمضية، قاعدية، متعادلة)
- يعتمد تصنيف الأملاح على نوع الحمض والقاعدة المكونين للملح.
- الأملاح المتعادلة : يكون الرقم الهيدروجيني لمحلولها (7) وتنتج من تفاعل محاليل الحموض القوية والقواعد القوية فمثلًا:
- ينتج ملح كلوريد الليثيوم LiCl من تفاعل حمض HCl القوي والقاعدة القوية هيدروكسيد الليثيوم LiOH
- الأملاح الحمضية : يكون الرقم الهيدروجيني لمحلولها أقل من (7)، وتنتج من تفاعل محاليل الحموض القوية مع القواعد الضعيفة فمثلًا :
- ينتج ملح كلوريد الأمونيوم NH4Cl من تفاعل حمض HCl القوي مع القاعدة الضعيفة NH3
- الأملاح القاعدية : يكون الرقم الهيدروجيني لمحاليلها أكبر من (7)، وتنتج من تفاعل الحموض الضعيفة والقواعد القوية فمثلًا :
-
ملح إيثانوات الصوديوم CH3COONa الذي يتكون من تفاعل حمض الإيثانويك CH3COOH الضعيف مع القاعدة القوية NaOH
- مؤشرات حدوث التفاعل الكيميائي :
- يمكن الاستدلال على حدوث تفاعل كيميائي عن طريق بعض المشاهدات التي ترافق حدوث التفاعل مثل :
* تصاعد غاز في أثناء حدوث التفاعل
* تكون مادة راسبة عن التفاعل.
* حدوث تغير في درجة حرارة المحلول الناتج كما يحدث عند تعادل حمض مع قاعدة .
- تحضير الحموض والقواعد صناعيًا :
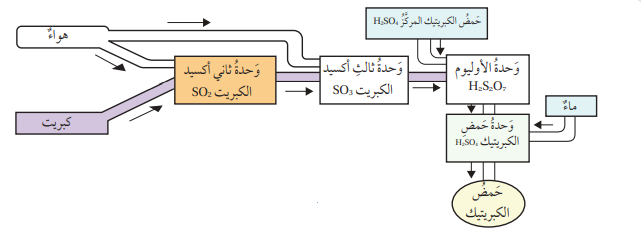
1. حمض الكبريتيك H2SO4 :
- يدخل حمض الكبريتيك في العديد من الصناعات منها: صناعة الأسمدة الفوسفاتية، الورق، الأصباغ، المنظفات، المطاط، وبطاريات السيارات .
- يحضر حمض الكبريتيك بطريقة التلامس Contact Process،
- التي تتضمن صهر الكبريت الصلب ثم حرقه بوجود كمية كافية من الأكسجين لإنتاج غاز ثاني أكسيد الكبريت SO2
- ثم يخلط غاز ثاني اكسيد الكبريت مع الأكسجين ويسخن الخليط إلى درجة حرارة 450° وعند ضغط مناسب، يستخدم خامس أكسيد الفناديوم V2O5 عاملًا مساعدًا لتسريع حدوث التفاعل فينتج غاز ثالث أكسيد الكبريت SO3 .
- يمكن إذابة غاز SO3 في حمض الكبريتيك المركز المحضر سابقًا لإنتاج الأوليوم H2S2O7 ، الذي يتفاعل مع الماء لإنتاج حمض الكبريتيك
- الشكل الآتي يمثل خطوات تحضير حمض الكبريتيك :
2. حمض الفسفوريك H3PO4 :
- يعد الأردن الدولة الثانية في العالم من حيث كميات خام الفوسفات الموجود فيها، ومن أهم المواد التي تُصنع من خام الفوسفات؛ حمض الفسفوريك، ويُستخدم في إنتاج الأسمدة الفوسفاتية، والأعلاف الحيوانية وصناعة السيراميك.
- يصنع حمض الفسفوريك بنقل الخام إلى المصنع ثم طحن صخور الفوسفات حتى تصبح حبيبات صغيرة، ثم يتفاعل فوسفات الكالسيوم مع حمض الكبريتيك
- ثم ينقل حمض الفسفوريك إلى خزانات خاصة لحفظه.
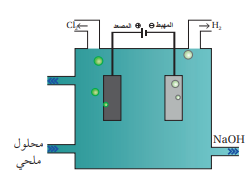
3. هيدروكسيد الصوديوم NaOH :
- يعرف هيدروكسيد الصوديوم NaOH بالصودا الكاوية، ويدخل في العديد من الصناعات مثل : صناعة الصابون ومواد التنظيف وإزالة عسر الماء وصناعة الزجاج والورق والنسيج وغيرها .
ينتج هيدروكسيد الصوديوم بعملية التحليل الكهربائي لمحلول كلوريد الصوديوم؛ حيث ينتج عن التحليل الكهربائي غاز الكلور وغاز الهيدروجين ومحلول هيدروكسيد الصوديوم
- الشكل الآتي يمثل التحليل الكهربائي لمحلول كلوريد الصوديوم NaCl :
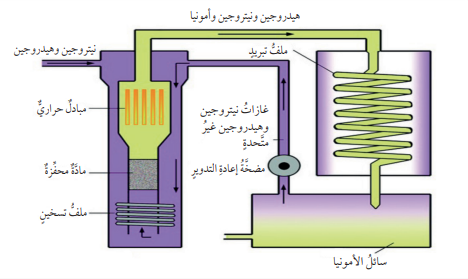
3. الأمونيا NH3:
- تعرف الأمونيا بــالنشادر؛ وهي غاز عديم اللون يمكن إسالته بالضغط أو التبريد، ويستخدم في تحضير حمض النيتريك وصناعة الأسمدة النيتروجينية والمطاط والنسيج، وبعض أنواع محاليل التنظيف المنزلية وغيرها.
- تُنتج الأمونيا صناعيًا بطريقة (هابر) حيث :
- يخلط غاز الهيدروجين والنيتروجين في مغاعل خاص عن درجة حرارة وضغط مناسبين، وباستخدام فلز الحديد عاملًا مساعدًا للتفاعل،
- الشكل الآتي يوضح خطوات تحضير الأمونيا صناعيًا بواسطة طريقة (هابر):