النماذج الذرية : ( Atomic Models):
النموذج الذري (Atomic Model) : وهو تمثيل تخطيطي للجسيمات التي تتكون منها الذرة وأماكن تواجدها، والشكل الآتي يبين بعض النماذج الذرية :
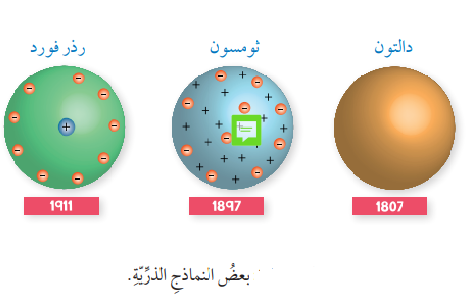
1.نظرية دالتون الذرية (Dalton’s Atomic Theory) :
وصف الذرة بأنها جُسيم كروي متناهٍ في الصغر لا يمكن تجزئته إلى أجزاء أصغر منه
- الشكل الآتي يبين نموذج دالتون :

2.نموذج ثومسون (Thomson’s Model):
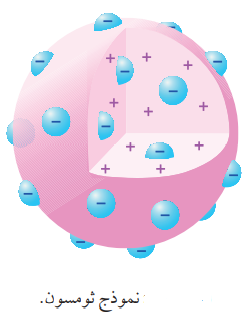
- نموذج ثومسون (Thomson’s Model) : الذي يفترض فيه :
" أن الذرة كرة متجانسة من الشحنات الموجبة، غُرس فيها عدد من الإلكترونات سالبة الشحنة "
- الشكل الآتي يوضح نموذج ثومسون :
3. نموذج رذرفورد النووي (Rutherford’s Nuclear Model):
- نموذج رذرفورد النووي إفترض أن :
" الذرة لها نواة صغيرة جدًا مشحونة بشحنة موجبة، تتركز فيها كتلة الذرة وتدور حولها الإلكترونات سالبة الشحنة وأن معظم حجم الذرة فراغ"
- الشكل الآتي يبين نموذج رذرفورد النووي :
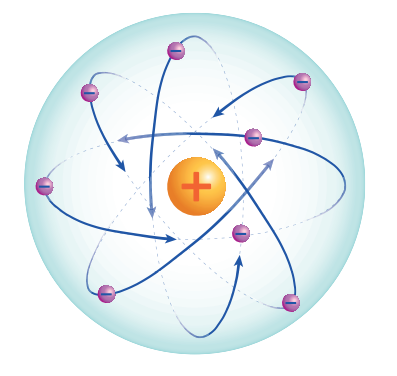
- قد وجد أن البروتونات والنيوترونات تتمركز في وسط الذرة في ما يسمى بـالنواة Nucleus بينما توجد الإلكترونات حول التواة وتتحرك في مسارات محددة
- الشكل الآتي يبين التركيب العام للذرة :

تجارب التحليل الكهربائي (Electrolysis Experiments) :
- جرى التوصل إلى أن " الذرة تحتوي جسيمات سالبة يمكن أن تفقدها أو تكتسبها عند تفاعلها"
"وقد جرى لاحقًا إثبات وجود هذه الجسيمات والتعرف إلى خصائصها وأطلق عليها إسم الإلكترونات"
التفريغ الكهربائي (Electrical Discharge Experiments) :
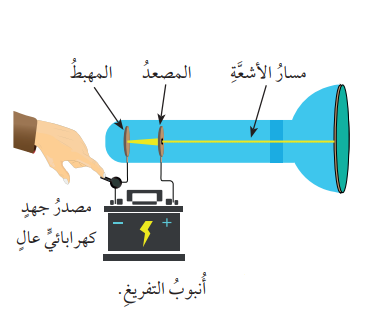
- أُنبوب التفريغ الكهربائي (Cathode Ray Tube):
- هو أنبوب زجاجي يحتوي على غاز معين تحت ضغط منخفض جدًا، مزود بصفيحة فلزية تمثل القطب السالب، وصفيحة أخرى تمثل القطب الموجب، وعند توصيل القطبين بالمصدر الكهربائي؛ يلاحظ إنطلاق حزمة من الأشعة داخل الأُنبوب الزجاجي كما في الشكل الآتي :
النظائر (Isotopes) :
- النظائر: هي عناصر يكون لذراتها العدد الذري نفسه، ولكنها تختلف في العدد الكتلي لإختلاف عدد النيوترونات في أنويتها
- تحتوي ذرات العنصر على عدد من البروتونات مساوٍ لعدد الإلكترونات فيها
- قد وجد أن بعض العناصر قد تحتوي على أعداد مختلفة من النيوترونات في بعض أنوية ذراتها أي أن لها العدد الذري نفسه ولكنها تختلف في العدد الكتلي ويطلق على هذه العناصر إسم النظائر وقد يكون للعنصر نفسه نظيران أو أكثر.
- النظائر المشعة : هي عناصر لذراتها القدرة على إطلاق الإشعاعات بصورة تلقائية