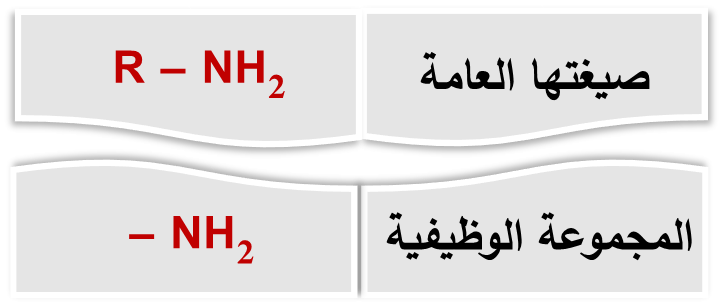
المجموعات الوظيفية
نشاط استهلالي
♦ أُلاحظ التشابُّه والفرق بين المُركّبين.
♦ أُلاحظ الفرق بين المُركّبين أعلاه وهذا المُركّب.
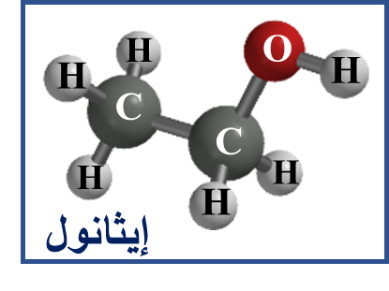
♦ أُلاحظ التشابُّه والفرق بين المُركّبات الآتية:
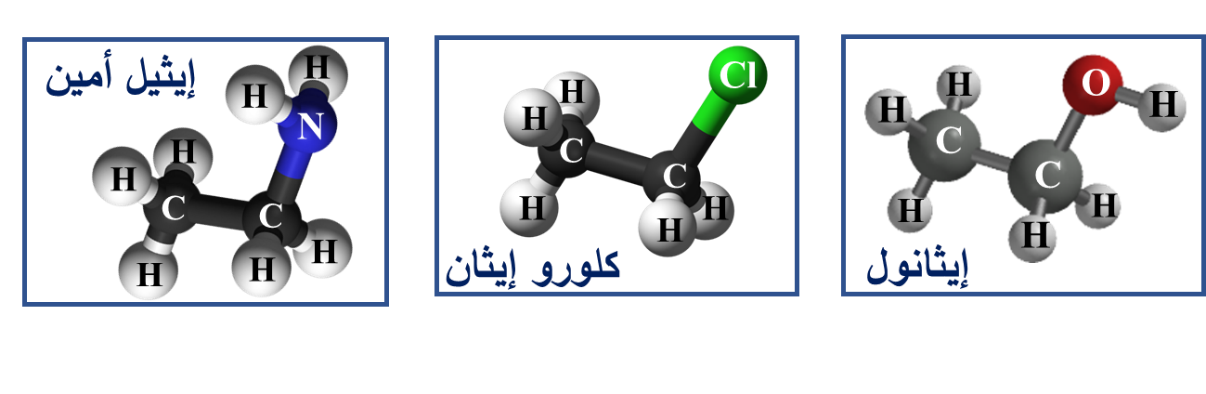
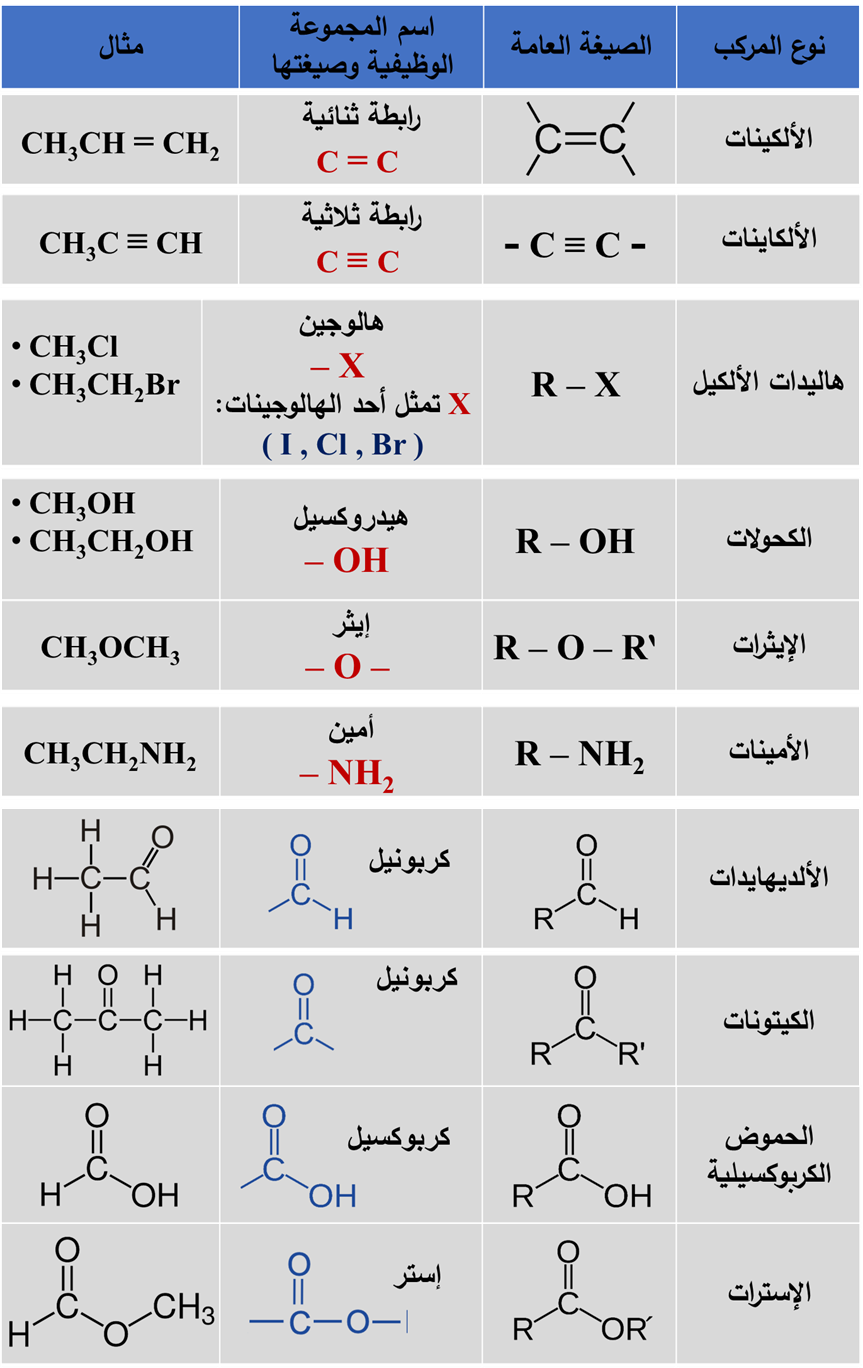
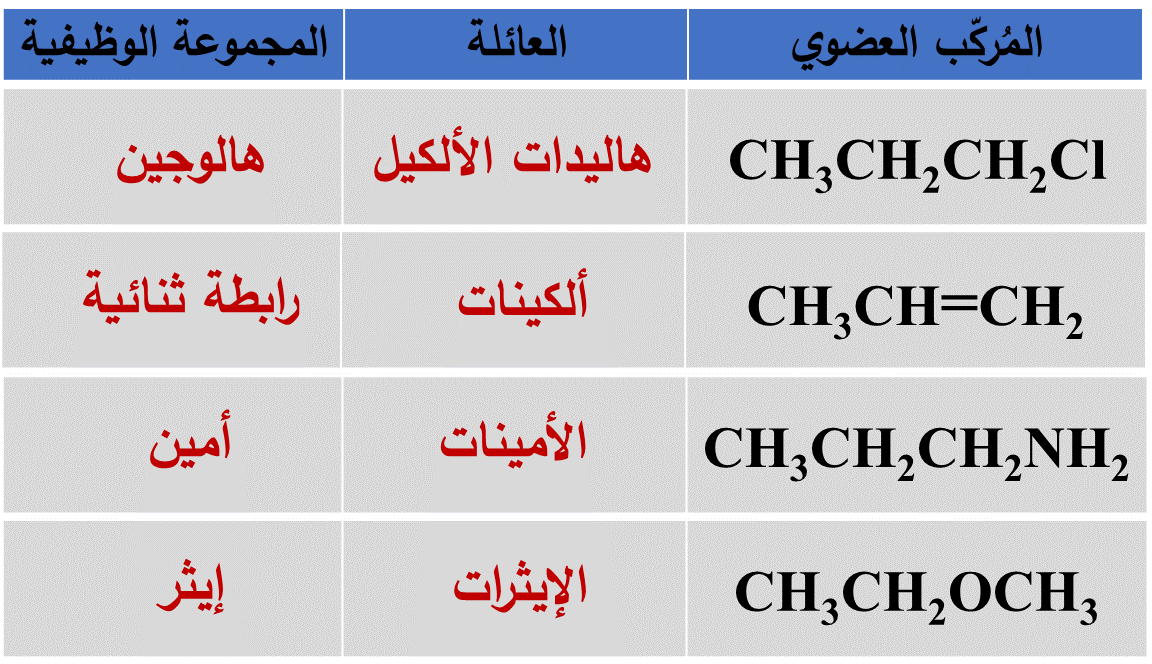
♯ صُنفت المُركّبات العضوية إلى أنواع عدّةٍ اعتمادًا على التشابُه في تركيبها البنائي:
فهناك مجموعة من المُركّبات العضوية تحوي بالإضافة للكربون والهيدروجين ذرةَ أو أكثر من عناصر أخرى.
سميت هذه المُركّبات مشتقات المُركّبات الهيدروكربونية
فماذا نقصد بمشتقات المُركّبات الهيدروكربونية؟
مشتقات المُركّبات الهيدروكربونية Derivatives Of Hydrocarbons مُركّباتٌ عضوية تحتوي بالإضافة للكربون والهيدروجين على ذرة أو أكثر من عناصرَ أخرى؛ مثل:
الأكسجين، أو الهالوجين، أو النيتروجين، أو الكبريت، أو الفسفور.
وإن وجود هذه الذرات وطريقة ترابُطِها مع الكربون يُكسب المُركّب خصائص كيميائية محددة ومميزة له.
حيث: سميت الذرة، أو مجموعة الذرات، أو الروابط المسؤولة عن الخصائص المميزة للمُركّب العضوي التي تُعدُّ مركز النشاط الكيميائي فيه
المجموعةَ الوظيفية Functional Group
- تتشابهُ المُركّبات العضويةُ التي تحتوي على المجموعة الوظيفية نفسِها في خصائصها الكيميائية:
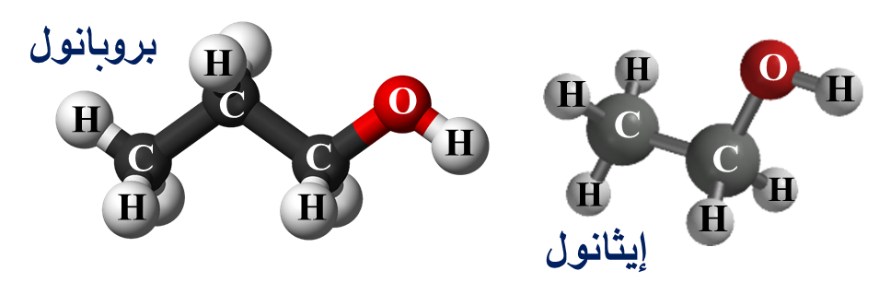
- تختلف المُركّبات العضويةُ التي لا تحتوي على المجموعة الوظيفية نفسِها في خصائصها الكيميائية:
تصنيف المُركّبات العضوية حسب المجموعة الوظيفية المميزة لكلّ منها
مثال: أصنّفُ المُركّبات العضوية الآتية حسب نوعها:
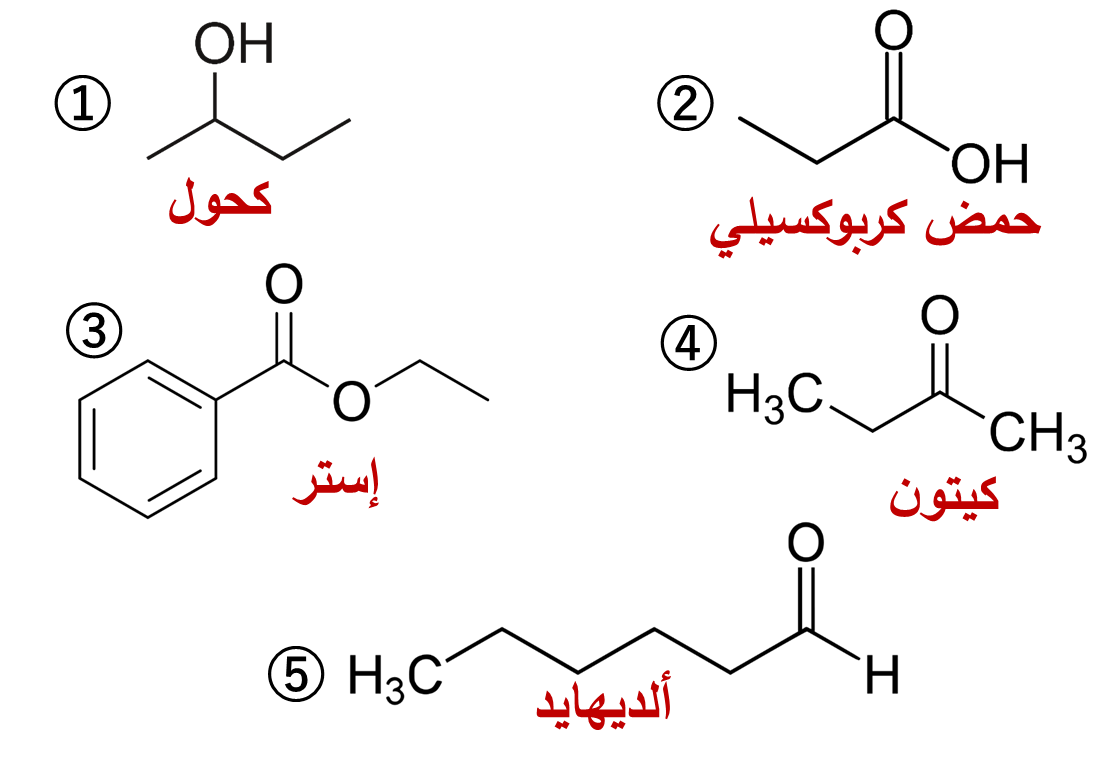
مثال: أحدد العائلة التي ينتمي إليها كل من المُركّبات العضوية الآتية، ثم أحدد المجموعة الوظيفية لكل منها:
هاليدات الألكيل
![]() اعتقاد سائد
اعتقاد سائد
هاليداتِ الألكيل من المُركّبات العضوية قليلة الانتشار في الطبيعة !!
![]() في الحقيقة
في الحقيقة
أن عددًا من الكائنات الحيّة تقوم بإفرازها
- تُنتج الأعشاب البحرية كميّاٍت هائلةً كلوروميثان CH3Cl
- يُنتِج النملُ الأبيض الكلوروفورم CHCl3
- يُنتِج الإسفنج البحريُّ والمرجان هاليداتٍ عُضويّةً كنوع من الحماية لإبعاد الأسماك والحيوانات المفترسة
فماذا نقصد بهاليدات الألكيل؟
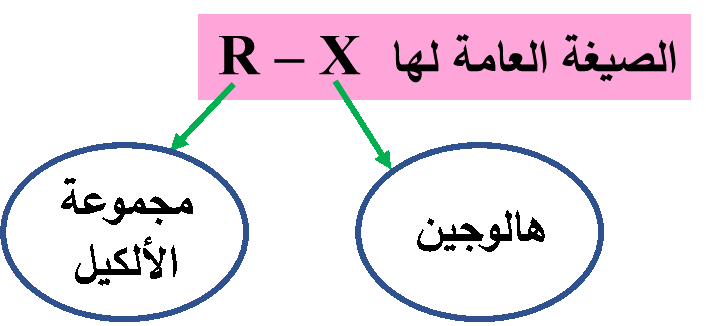
هاليدات الألكيل Alkyl Halides: مُركّبات هيدروكربونية حلت فيها ذرة هالوجين أو أكثر محلّ ذرة أو ذرات هيدروجين.
وهي: أبسط المشتقات الهيدروكربونية
♯ تسميةُ هاليدات الألكيل:
► الطريقة الشائعة لتسمية هاليدات الألكيل:
في هذه الطريقة ينظر للمُركّب على أنه مُكوّنٌ من جزئين:
⦿ الجزء الأول: يُمثّل الهالوجين يُسمّى هاليد
⦿ الجزء الثاني: يُمثّل مجموعة الألكيل R الميثيل ، الإيثيل ، البروبيل .....
- أمثلة على الأسماء الشائعة لبعض هاليدات الألكيل:
CH3F فلوريد الميثيل
CHCl3 ثلاثي كلوريد الميثيل ويسمى أيضًا: الكلوروفورم
CH3CH2Br بروميد الإيثيل
► تسميةُ هاليدات الألكيل وفقَ نظام التسمية الدولي الأيوباك IUPAC
تُسمّى هاليدات الألكيل بالطريقة نفسها التي تُسمّى بها الألكانات:
حيث: يعامل الهالوجين بوصفه تفرُّعًا على سلسلة الألكان
يكون الاسم العام لها هالو ألكانات
- أمثلة على الأسماء النظامية لبعض هاليدات الألكيل:
CH3Cl كلورو ميثان CH3CH2Br برومو إيثان
مثال: أُسمّي المُركّب الآتي وفقَ نظام التسمية العالمي .(IUPAC)
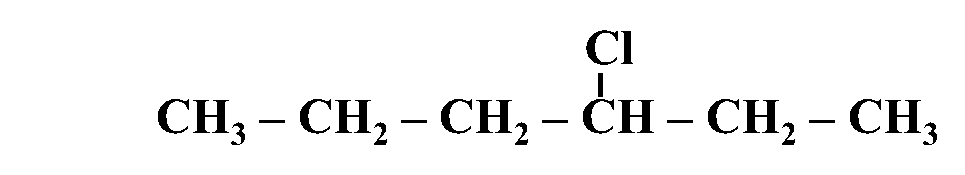
الحل:
أولًا: أُحدّدُ أطول سلسلة كربونية تتضمّن الهالوجين وأُسمّيها حسب عدد ذرات الكربون فيها

ثانيًا: أُحدّدُ ذرة الهالوجين وموقعها على السلسلة؛ بحيث أُرقّم السلسلة من الجهة التي يكون فيها لِذرّة الكربون المرتبطة بذرة الهالوجين أقلّ رقمٍ مُمكن
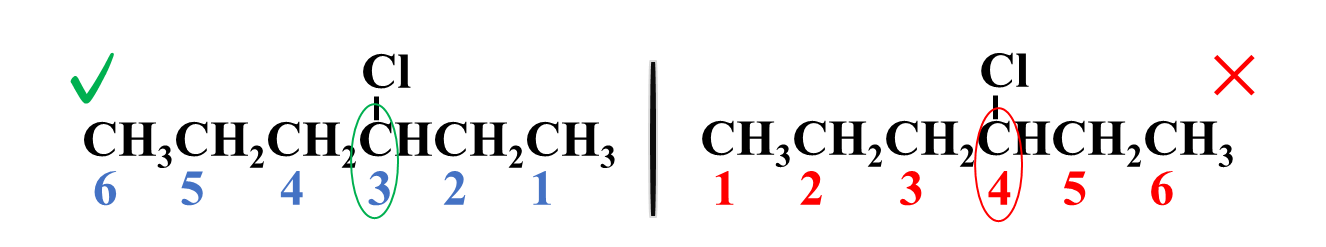
ثالثًا: أكتبُ رقم ذرة الكربون المرتبطة بذرة الهالوجين متبوعًا بشرطة (-) لفصل الأرقام عن الكلّمات، ثم أُسمّي الهالوجين على وزن (هالو)
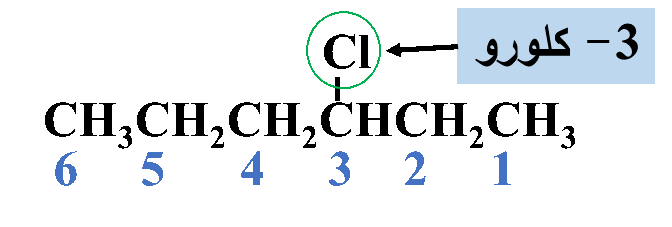
رابعًا: أكتبُ أسم المركب كاملًا
3- كلورو هكسان
مثال: أُسمّي المُركّب الآتي وفقَ نظام التسمية العالمي .(IUPAC)
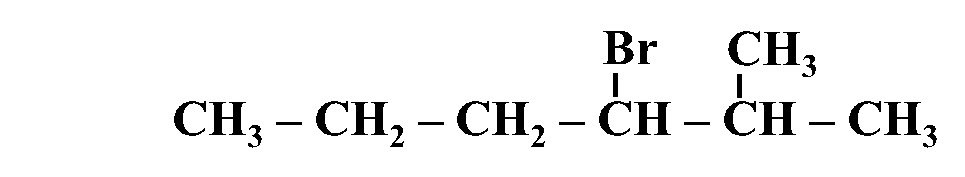
الحل:
أولًا: أُحدّدُ أطول سلسلة كربونية تتضمّن الهالوجين وأُسمّيها حسب عدد ذرات الكربون فيها
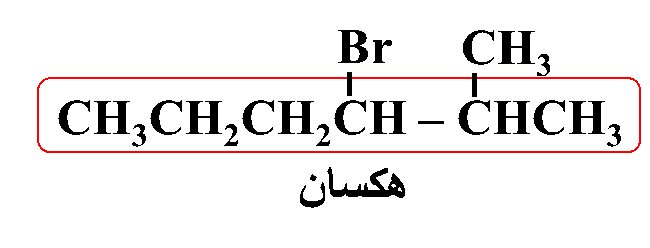
ثانيًا: أُحدّدُ ذرة الهالوجين وموقعها على السلسلة؛ بحيث أُرقّم السلسلة من الجهة التي يكون فيها لِذرّة الكربون المرتبطة بذرة الهالوجين أقلّ رقمٍ مُمكن
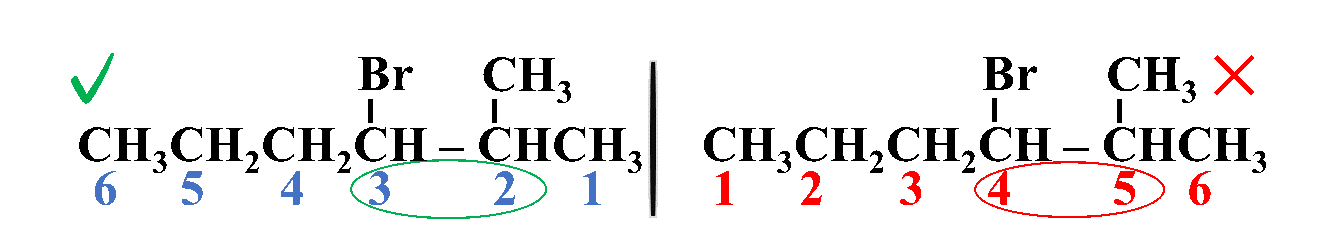
ثالثًا: أُحدّدُ التفرُّعات ومواقعها؛ بحيث أُرقّم السلسلة من الجهة التي يكون فيها لذرات الكربون المرتبطة بكلٍّ من ذرة الكلور أو مجموعة الميثيل أقلّ أرقام ممكنة
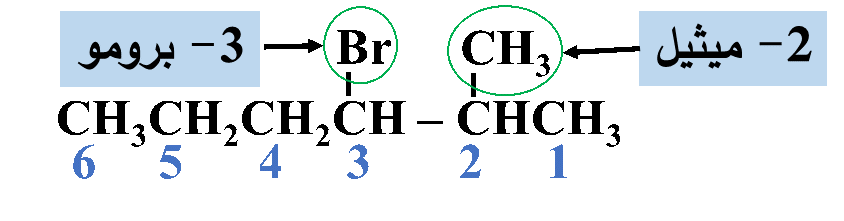
رابعًا: أكتبُ أسم المركب كاملًا
3- برومو -2- ميثيل هكسان
مثال: أُسمّي المُركّب الآتي وفقَ نظام التسمية العالمي .(IUPAC)
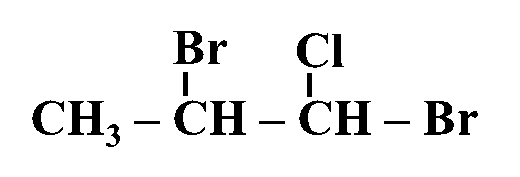
الحل:
أولًا: أُحدّدُ أطول سلسلة كربونية تتضمّن الهالوجين وأُسمّيها حسب عدد ذرات الكربون فيها
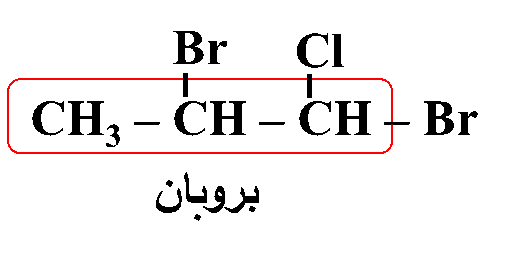
ثانيًا: أُحدّدُ ذرة الهالوجين وموقعها على السلسلة؛ بحيث أُرقّم السلسلة من الجهة التي يكون فيها لِذرّة الكربون المرتبطة بذرة الهالوجين أقلّ رقمٍ مُمكن
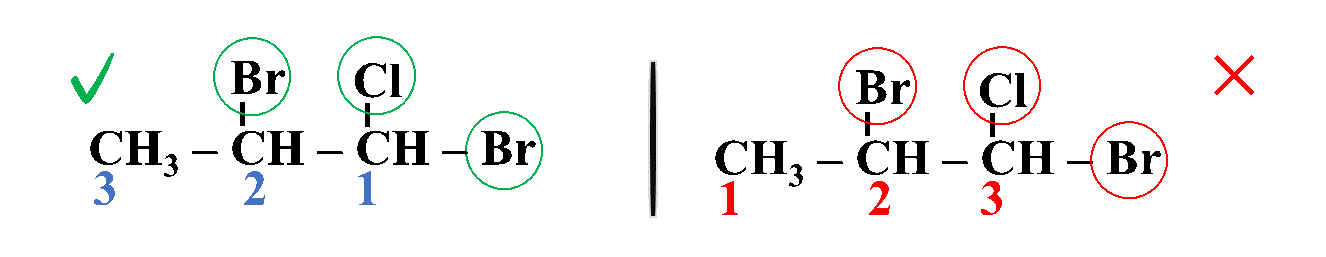
ثالثًا: أُحدّدُ التفرُّعات ومواقعها؛ بحيث أُرقّم السلسلة من الجهة التي يكون فيها لذرات الكربون المرتبطة بكلٍّ من ذرة الكلور والبروم أقلّ أرقام ممكنة
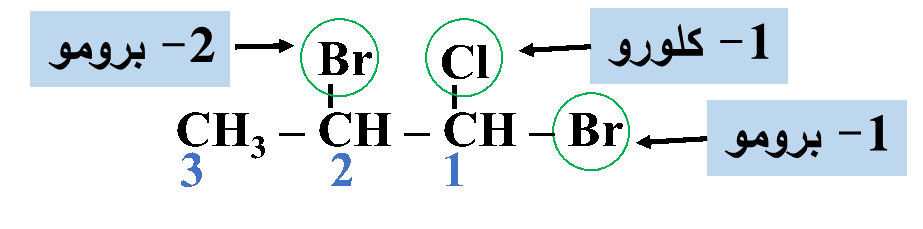
رابعًا: أكتبُ أسم المركب كاملًا
1، 2- ثنائي برومو -1- كلورو هكسان
مثال: أكتبُ الصيغة البنائية للمُركّب: 3- إيثيل - 4 - برومو هبتان
الحل: البادئة هبت تعني وجود 7 ذرات كربون في السلسلة الأطول؛ نقوم بكتابتها وترقيمها
C – C – C – C – C – C – C
7 6 5 4 3 2 1
نحدد مكان وجود التفرعات لكل من الهالوجين ومجموعة الألكيل -إن وجدت- ونقوم بكتابتها
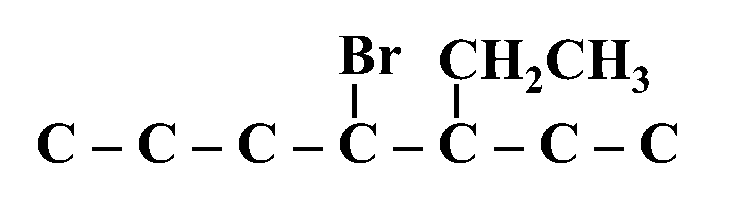
نقوم بوضع ذرات الهيدروجين على ذرات الكربون بحيث تمتلك كل ذرة اربع روابط تساهمية
الخصائص الفيزيائية لهاليدات الألكيل
تُعدُّ الرابطة بين ذرة الهالوجين وذرة الكربون في هاليدات الألكيل رابطة قطبية
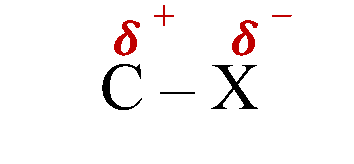
لذلك فهاليداتُ الألكيل مُركّبات قطبية تترابط بقوى تجاذب ثنائية القطب
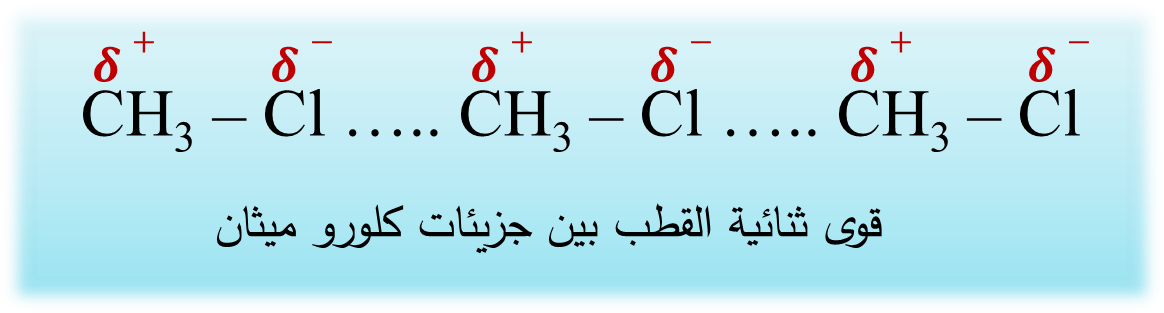
تتأثّر الخصائصُ الفيزيائية لهاليدات الألكيل بقوى التجاذب بين جزيئاتها
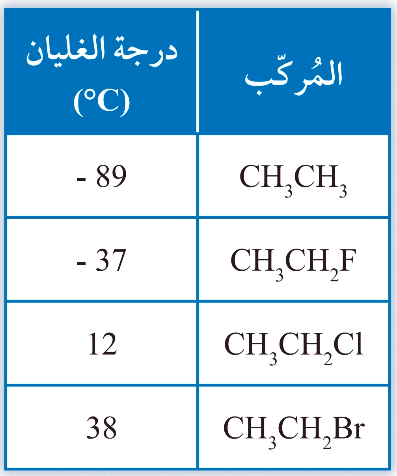
مثلًا: درجة غليان الإيثان أقلّ منها لفلورو إيثان؛ أُفسر سبب ذلك؟ (اعتمادًا على الجدول اعلاه)
جزيئات الإيثان غيرُ قطبيّة تترابط بقوى لندن الضعيفة.
بينما فلورو إيثان جزئ قطبيٌّ تترابط جزيئاته بقوى ثنائية القطب.
لذلك درجة غليان الفلورو إيثان هي الأعلى
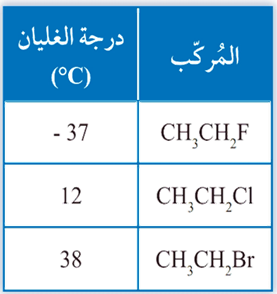
يُلاحظ ازدياد درجة الغليان بالانتقال من فلورو إيثان إلى برومو إيثان؛ أُفسر سبب ذلك؟ (اعتمادًا على الجدول اعلاه)
بزيادة الكتلة الذرية للهالوجين تزداد الكتلة المولية لهاليد الألكيل، فتزدادُ قوى التجاذب بين جزيئاته، وتزداد درجة غليانه
♦ ومن الخصائص الفيزيائية الأخرى لهاليدات الألكيل:
- تتواجد غالبية هاليدات الألكيل بالحالة السائلة أو الصلبة عند درجة الحرارة العادية °25C
- وغالبًا لا تذوب هاليدات الألكيل في الماء رغم قُطبيّتِها؛ أُفسر سبب ذلك؟
لأن قوى التجاذب ثنائية القطب التي تنشأ بين جزيئات هاليد الألكيل وجزيئات الماء ضعيفة لا تتغلب على قوة الروابط الهيدروجينية بين جزيئات الماء، بالإضافة إلى الترابط بين جزيئات هاليد الألكيل نفسه
أهمية هاليدات الألكيل في الصناعة
لهاليدات الألكيل أهمية في الصناعة فقد تستخدم مباشرة أو تحضر منها مركبات مهمة.
- استُخدِم الكلوروفورم CHCl3قديمًا كمادة مخدّرة في العمليات الجراحية وبسبب آثاره الجانبية حل محله هاليد ألكيل آخر سمي الهالوثان
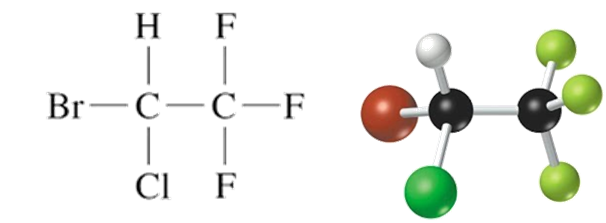
- تستخدم هاليدات الألكيل أيضًا كمذيبات عضوية مثل ثلاثي كلورو إيثين C2HCl3الذي يُستخدم في الصناعات الالكترونية
- استخدم ثلاثي كلورو فلورو ميثان CCl3F كمادة نفخ في صناعة البلاستيك الرغوي (الفوم)
- ويستخدم كلورو إيثين في صناعة أكثر أنواع البلاستيك استخدامّا، الذي يُستخدم في تمديدات شبكات المياه والصرف الصحي
- تستخدم بعض المُركّبات الهيدروفلوروكربونية كغازات مُبرّدة في الثلاجات وأجهزة التبريد.
الكحولات
أصبحَ استخدامُ مُعقّمات الأيدي شائعًا في الأمّاكن العامة مثل المستشفيات، والمطاعم، والأسواق التجارية، وغيرها.
- إذْ تحتوي هذه المُعقمات على مواد تؤدي للقضاء على الميكروبات للحدّ من انتقال الأمراض.
ورغم اختلاف المُعقّمات في بعض مكوّناتها؛ إلا أنّ معظمها يشترك في المادة الفعالة فيها وهي:
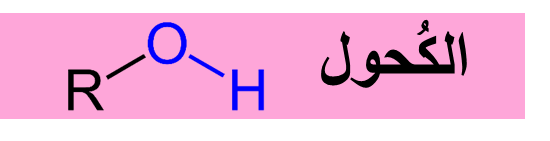
فماذا نقصد الكُحولاتُ؟
الكحولات Alcohols: مُركّباتٌ عضوية صيغتها العامة R-OHحيث تُمثّل مجموعة الهيدروكسيل (-OH)المجموعة الوظيفية المميزة لها وتُمثّلR مجموعة ألكيل.
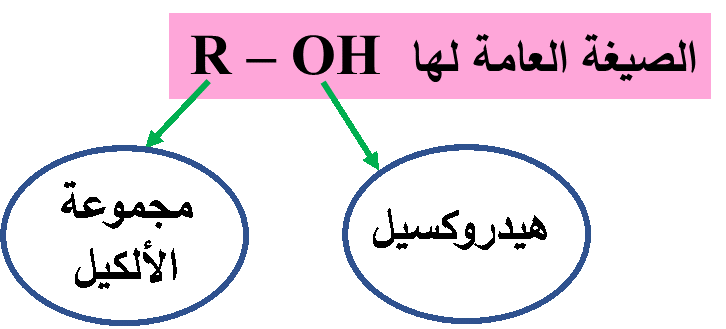
أبسط الكُحولات: الميثانول CH3OH
♯ تسميةُ الكُحولاتُ:
- تُسمّى الكحولات وفقَ نظام الأيوباك بإضافة المقطع (ول) إلى اسم الألكانِ المقابل فيصبح الاسم العام له (ألكانول).
مثال: أُسمّي المُركّب الآتي وفقَ نظام التسمية العالمي .(IUPAC)
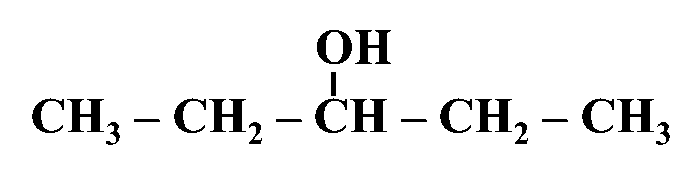
الحل:
أولًا: أُحدّدُ أطول سلسلة كربونية تتضمّن الهيدروكسيل (-OH)
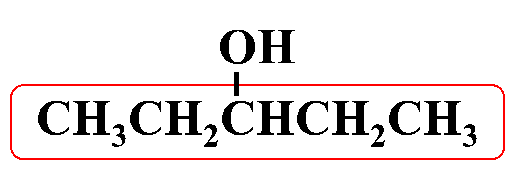
ثانيًا: أُرقّم ذرات الكربون في السلسلة الرئيسة مبتدئًا من الجهة الأقرب للمجموعة الوظيفية
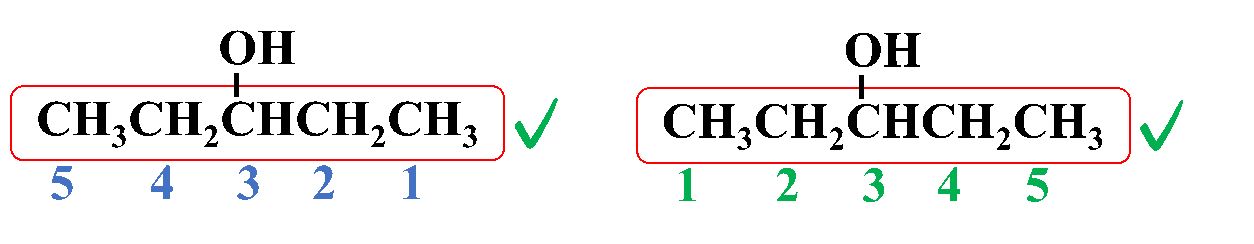
ثالثًا: أُحدّدُ موقع ارتباط مجموعة الهيدروكسيل وكذلك مجموعة الألكيل (إن وجدت) وأُسمّيها
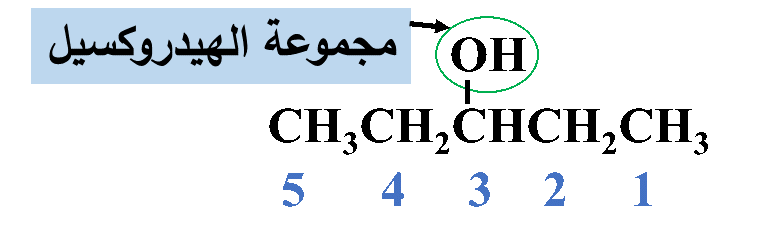
رابعًا: أكتبُ أسم المركب كاملًا
3- بنتانول
مثال: أُسمّي المُركّب الآتي وفقَ نظام التسمية العالمي .(IUPAC)
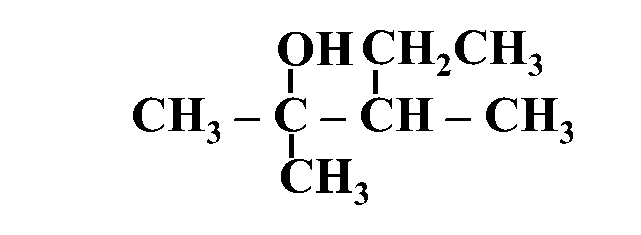
الحل:
أولًا: أُحدّدُ أطول سلسلة كربونية تتضمّن الهيدروكسيل (-OH)

ثانيًا: أُرقّم ذرات الكربون في السلسلة الرئيسة مبتدئًا من الجهة الأقرب للمجموعة الوظيفية
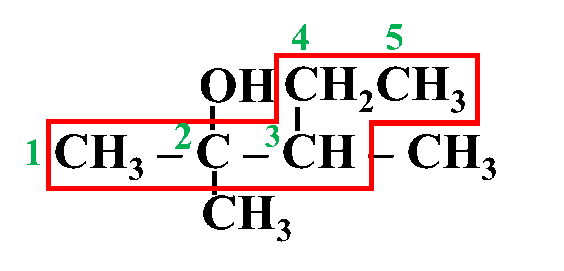
ثالثًا: أُحدّدُ موقع ارتباط مجموعة الهيدروكسيل وكذلك مجموعة الألكيل (إن وجدت) وأُسمّيها
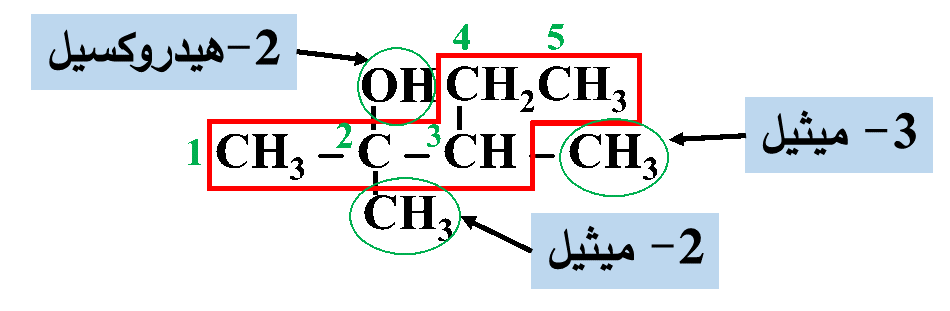
رابعًا: أكتبُ أسم المركب كاملًا
3، 2- ثنائي ميثيل -2- بنتانول
مثال: أكتبُ الصيغة البنائية للمُركّب: 6- ميثيل -4- هبتانول
الحل:
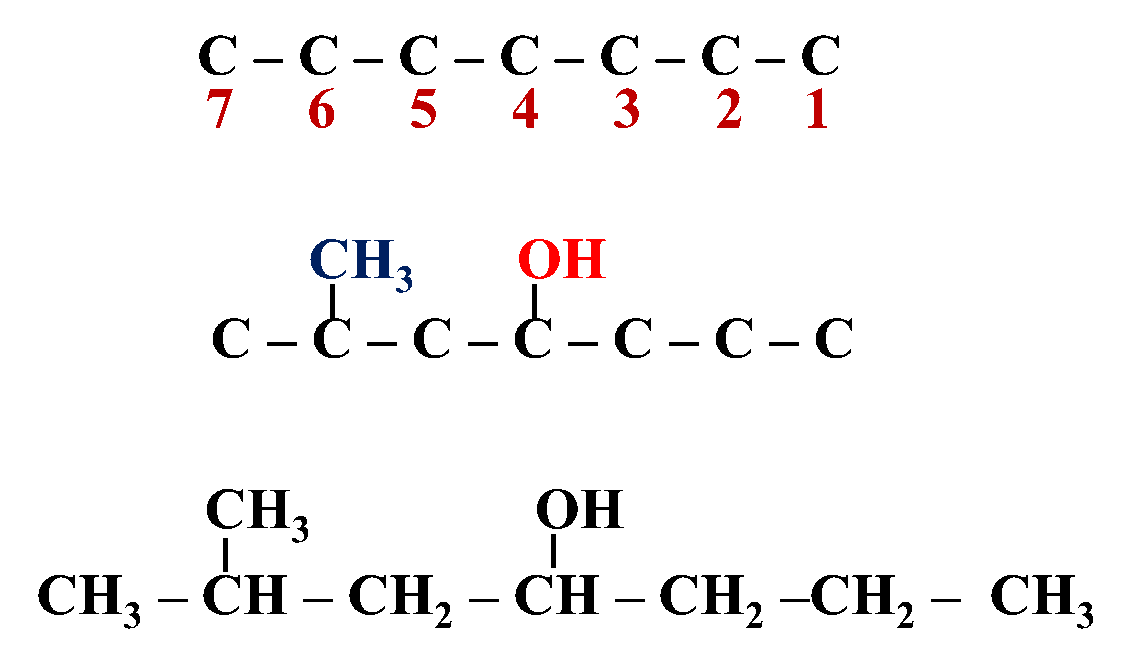
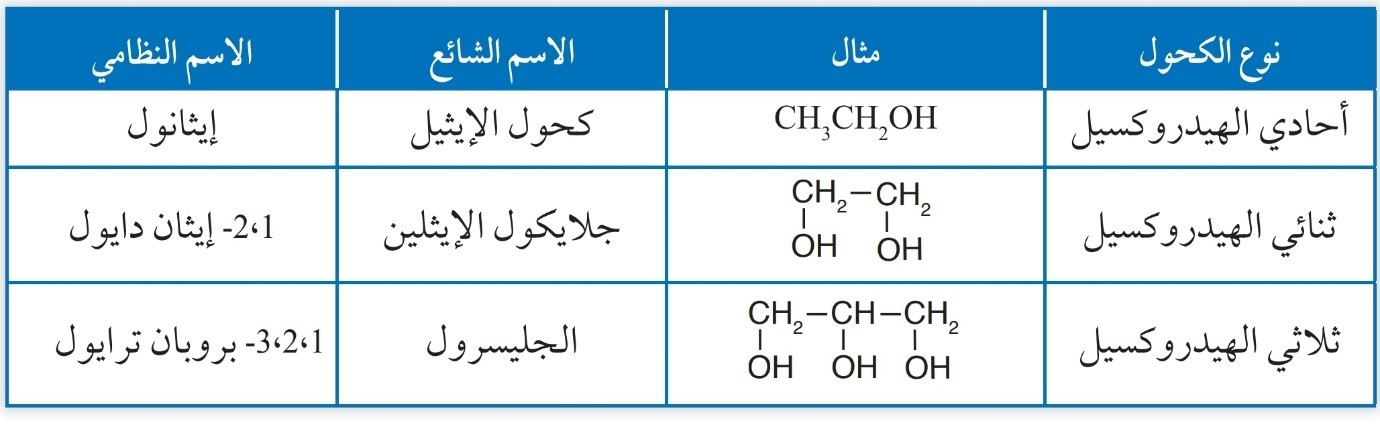
إحدى طرائق تصنيف الكحولات تعتمد على عدد مجموعات الهيدروكسيل(-OH) المرتبطة بسلسلة الكربون


الخصائص الفيزيائية للكُحولات
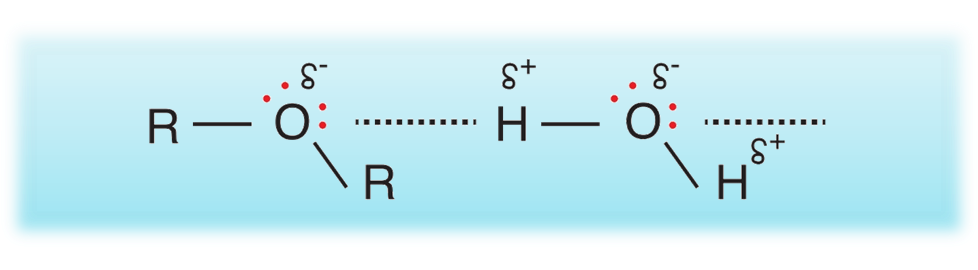
تحتوي الكحولات على مجموعة الهيدروكسيل -OH)) وهي مجموعة شديدة القطبية نظرًا للسالبية الكهربائية العالية لذرة الأكسجين.

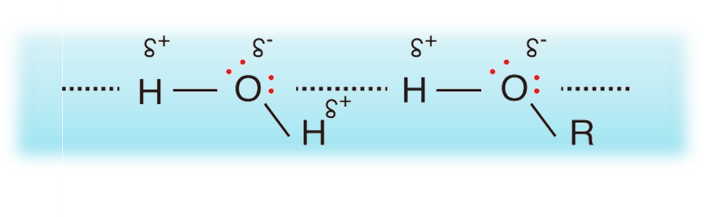
ونظرًا لارتباط ذرة الهيدروجين مباشرة بذرة الأكسجين فإنّ جزيئات الكحول تترابط في ما بينها بروابط هيدروجينية
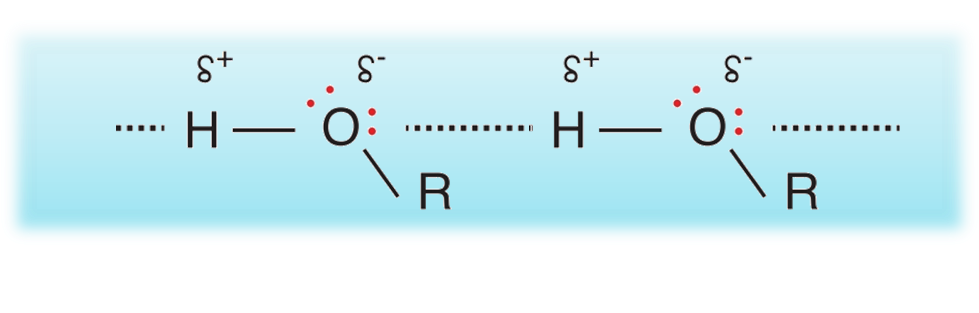
درجات غليان بعض الكحولات والألكانات المقاربة لها بالكتلة المولية
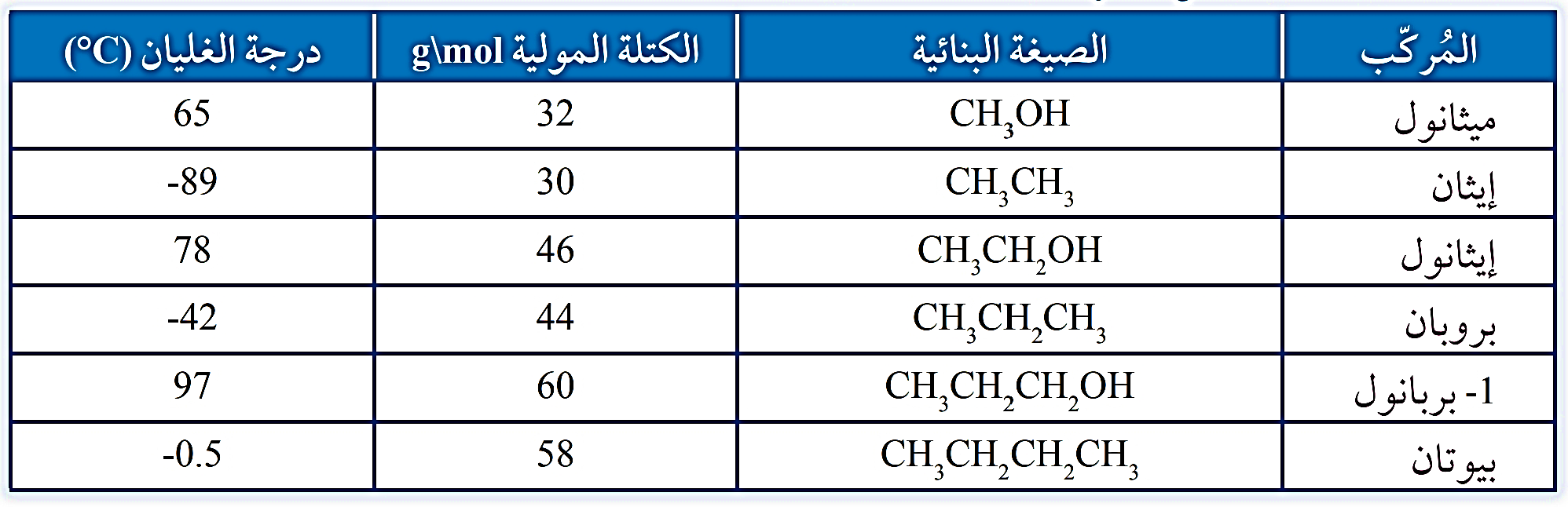
يلاحظُ ارتفاعُ درجة غليان الكحولات مقارنة بالألكانات المقاربة لها في الكتلة المولية
- وذلك بسبب قوة الرابطة الهيدروجينية بين جزيئات الكحول مقارنة بقوى لندن بين جزيئات الإيثان
ويتبين من الجدول أيضًا زيادة درجة غليان الكحولات بزيادة عدد ذرات الكربون (أي بزيادة كتلتها المولية)
- ذلك أنه يكون لجزيء الكحول طرفان أحدهما قطبيOH) -) يرتبط مع الجزيئات
الأخرى بروابط هيدروجينية والآخر غير قطبي (R)، يرتبط مع الجزيئات الأخرى بقوى لندن التي تزداد قوتُها بزيادة الكتلة المولية.
ذائبية الكحولات في الماء
إنّ قدرة جزيئات الكحولات على صنع روابط هيدروجينية مع الماء تُفسّر ذائبيتها فيه
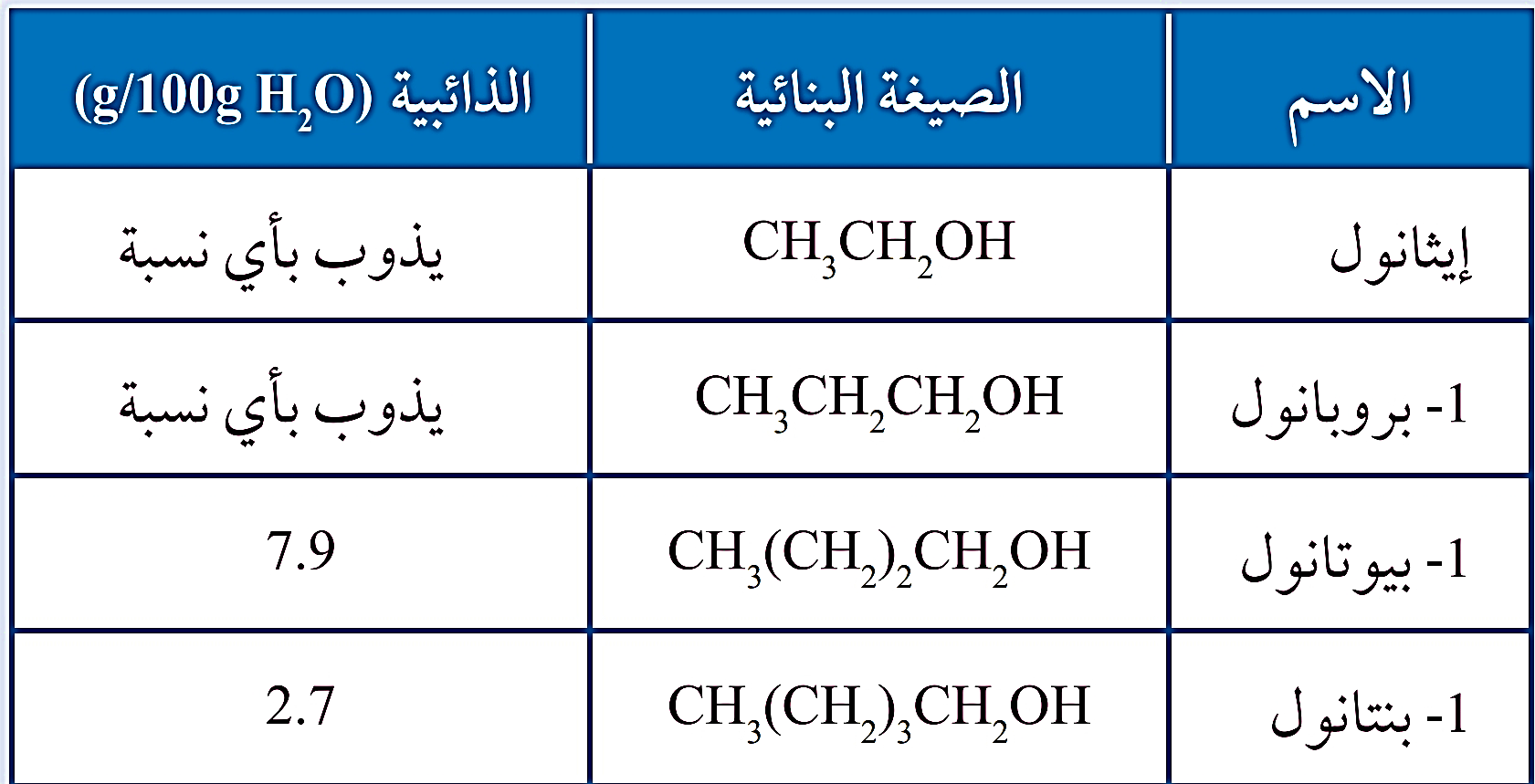
تقل ذائبية الكحولات في الماء بزيادة عدد ذرات الكربون فيها
ذلك أن زيادة عدد ذرات الكربون يزيد من طول السلسلة الكربونية Rفي المُركّب، وهي طرفٌ غيرُ قطبي لا يذوب في الماء، لذلك تقلُّ ذائبية الكحولات
الإيثرات Ethers
ترتبط فيها ذرة الأكسجين التي تُمثّل المجموعة الوظيفية بمجموعتي ألكيل
متشابهتين أو مختلفتين.
♯ تسميةُ الإيثرات:
تُسمّى الإيثرات بتسمية مجموعتي الألكيل تتبعها كلمة إيثر.
حيث: تُرتب مجموعات الألكيل إذا كانت مختلفة أبجديًّا.
وإذا كانت مجموعتا الألكيل متماثلتين؛ تستخدم البادئة ثنائي.
مثال: أُسمّي المُركّب الآتي وفقَ نظام التسمية العالمي .(IUPAC)
➀ CH3OCH3

➁ CH3OCH2CH3

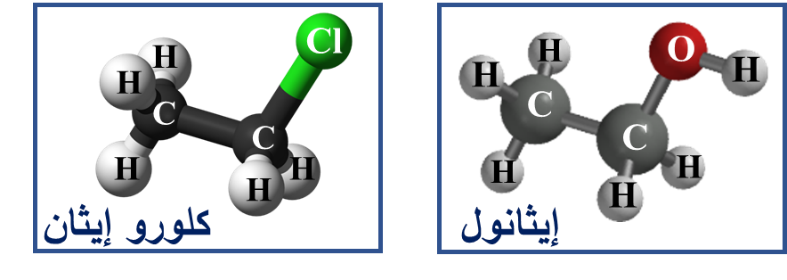
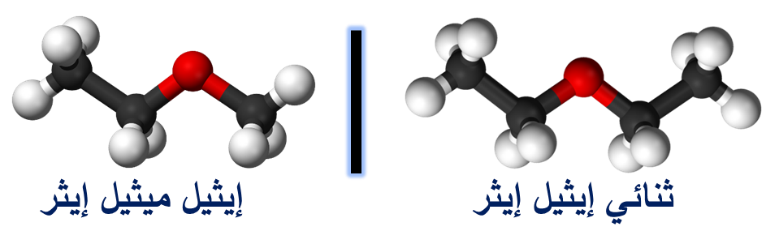
تتشابه الإيثرات والكحولات في الصيغة الجُزيئيّة؛ ولكنها تختلف في الصيغة البنائية
وتسمى هذه العملية بالتصاوغ
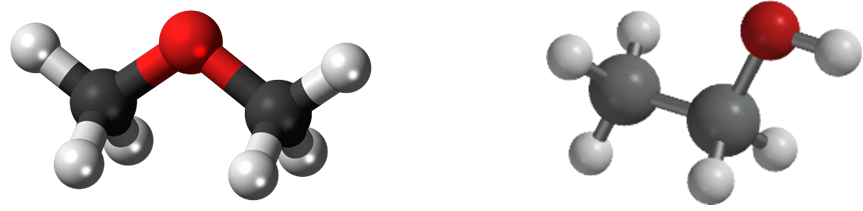
يلاحظُ من الشكل أن كلا المُركّبين يتكون من:
ذرتي كربون و6 ذرات هيدروجين وذرة أكسجين واحدة،
فالصيغة الجُزيئيّة لهما
C2H6O
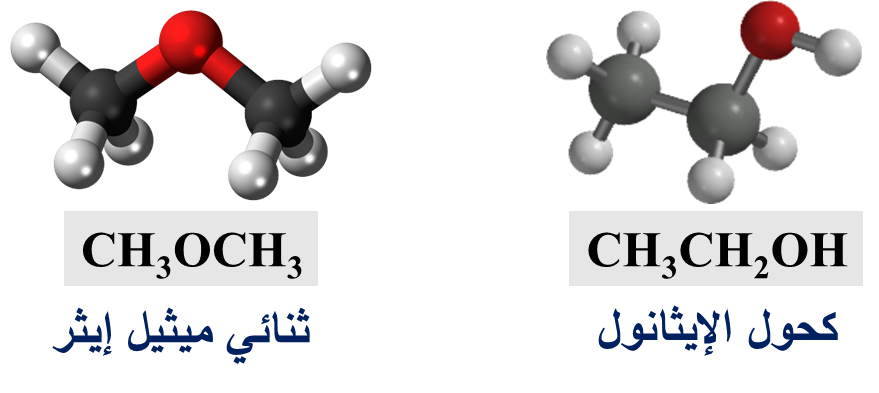
ماذا يسمى هذا النوع من التصاوغ؟
التصاوغ الوظيفي Functional Isomerism
الصيغة الجُزيئيّة العامة للكحولات والإيثرات
CnH2n+2O
مثال: أكتبُ المتصاوغات الوظيفية لمُركّب يحتوي على 3 ذرات من الكربون وذرة من الأكسجين؟
CnH2n+2O → C3H8O

الخصائص الفيزيائية للإيثرات
تتميز الإيثرات بأن روابط المجموعة الوظيفية فيها قطبية،
والرابطتان C-O-C تشكلان منحني زاوي
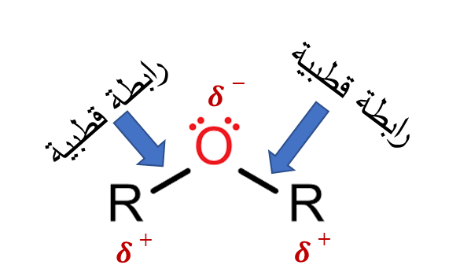
لذلك فإنّ جزيئات الإيثر قطبيةٌ تترابط في ما بينها بقوى ثنائية القطب
مقارنة درجة غليان بعض الإيثرات والألكانات المقاربة لها الكتلة المولية
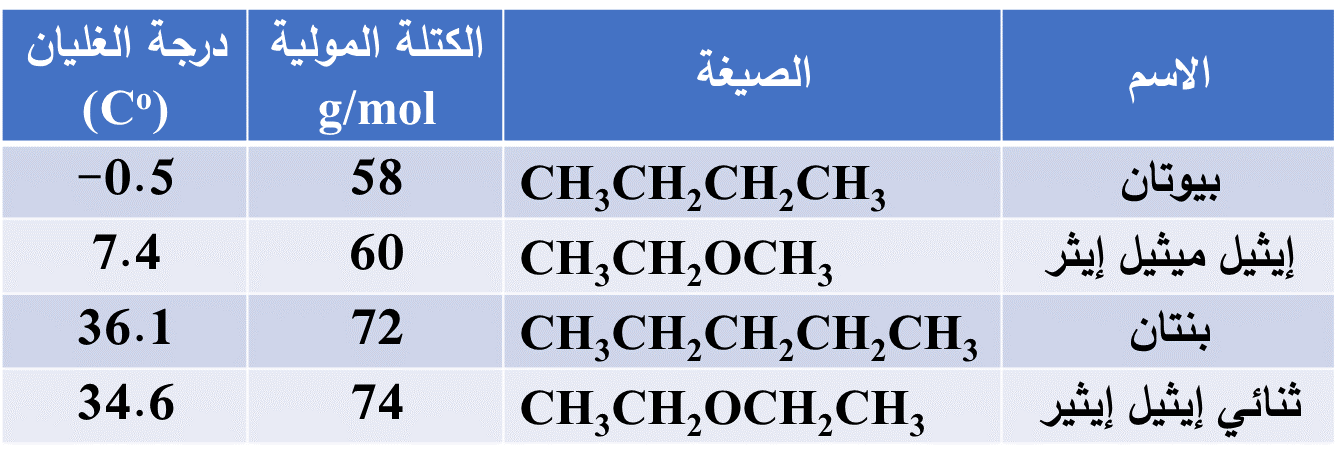
عند مقارنة درجة غليان إيثيل ميثيل إيثر والبيوتان، نجد تقارب درجة غليانهما، كذلك بالنسبة للبنتان وثنائي إيثيل إيثر يدل هذا التقارب على القطبية الضعيفة لجزيئات الإيثر
ذائبية الإيثرات في الماء
إنّ ما يفسر ذائبية الإيثرات في الماء:
هو امتلاك ذرة الأكسجين في الإيثر لزوجين من الإلكترونات غير الرابطة يَسمح لجزيئات الماء بعمل روابط هيدروجينية معها.
مقارنة ذائبية بعض الإيثرات بالكحولات في الماء
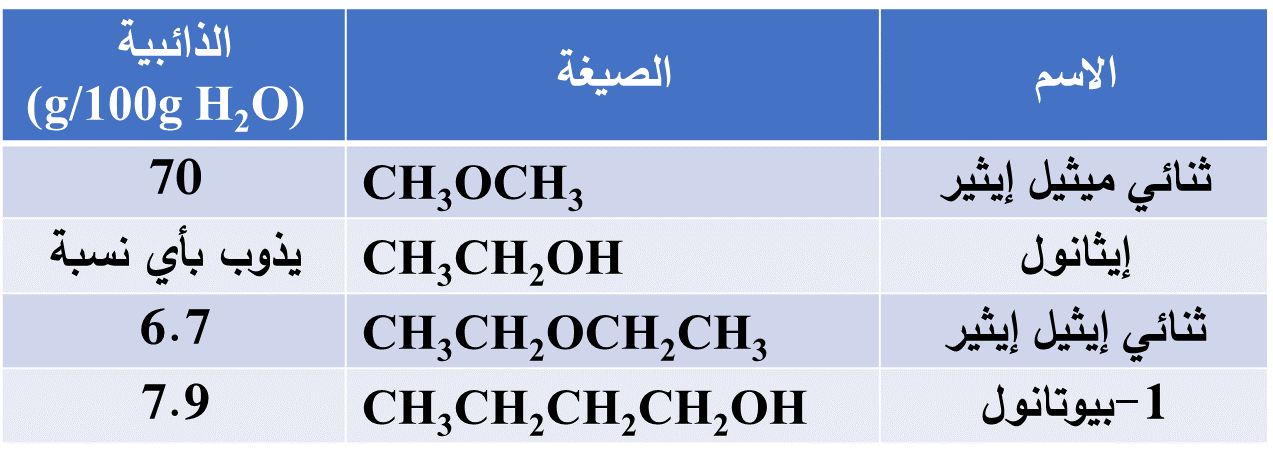
يلاحظ التقارب بين ذائبية الإيثرات والكحولات
- ذلك بسبب ترابط كل منهما بروابط هيدروجينية مع الماء
ولأن ذرة الأكسجين في الإيثر تحاط بمجموعتي ألكيل غير قطبيتين فإنهما تقللان من ذائبيته قليلاً
ويلاحظ نقصان ذائبية الإيثرات بزيادة عدد ذرات الكربون فيها
- ذلك لزيادة طول السلسلة الكربونية Rوهي طرف غير قطبي لا يذوب في الماء فتقل الذائبية
"تستخدم الإيثرات كمذيبات عضوية"
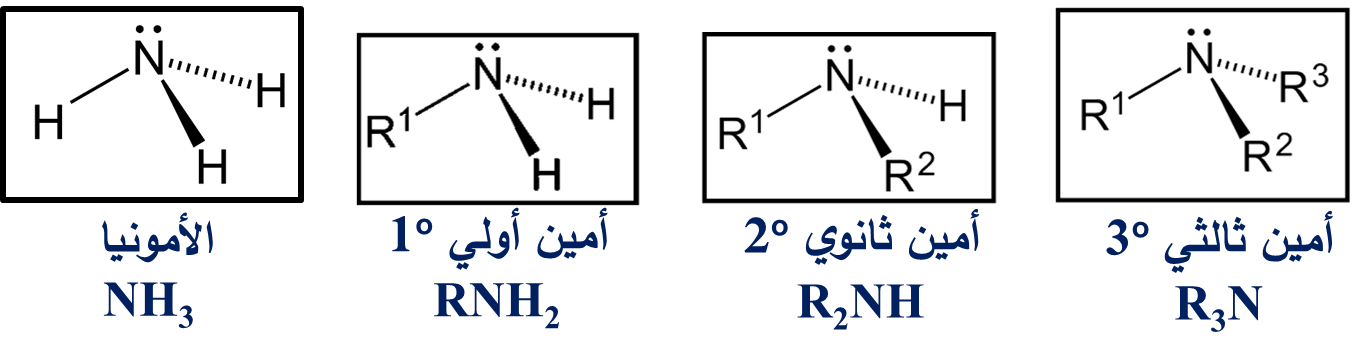
الأميناتAmines
تشتقُّ الأمينات Amines من الأمونيا NH3
♯ أهمية الأمينات:
- تنتشرُ الأمينات في الطبيعة، ولها رائحة تشبه السمك الفاسد.
تُستَخدم الأمينات في مجالات متنوعة مثل صناعة البلاستيك، والأدوية، والمبيدات الحشرية، وأصباغ الملابس

♯ تسميةُ الأمينات:
- تُسمّى الأمينات بتسمية مجموعة أو مجموعات الألكيلِ المُتّصلة بذرة النيتروجين تتبعها كلمة أمين
وتُرتّب مجموعات الألكيل أبجديًّا
وتُستخدم البادئة ثنائي أو ثلاثي إذا احتوى الأمين على مجموعات ألكيل متماثلة
إيثيل أمين CH3CH2NH2 ثلاثي ميثيل أمين (CH3)3N
ثنائي إيثيل أمين CH3CH2-NH-CH2CH3 إيثيل ميثيل أمين CH3CH2-NH-CH3
- الطريقة المتبعة لتسمية الأمينات الأولية وفقَ نظام الأيوباك:
تُعامل فيها مجموعة الأمين كتفرّعٍ مُتّصل بإحدى ذرات الكربون في سلسلة الكربون
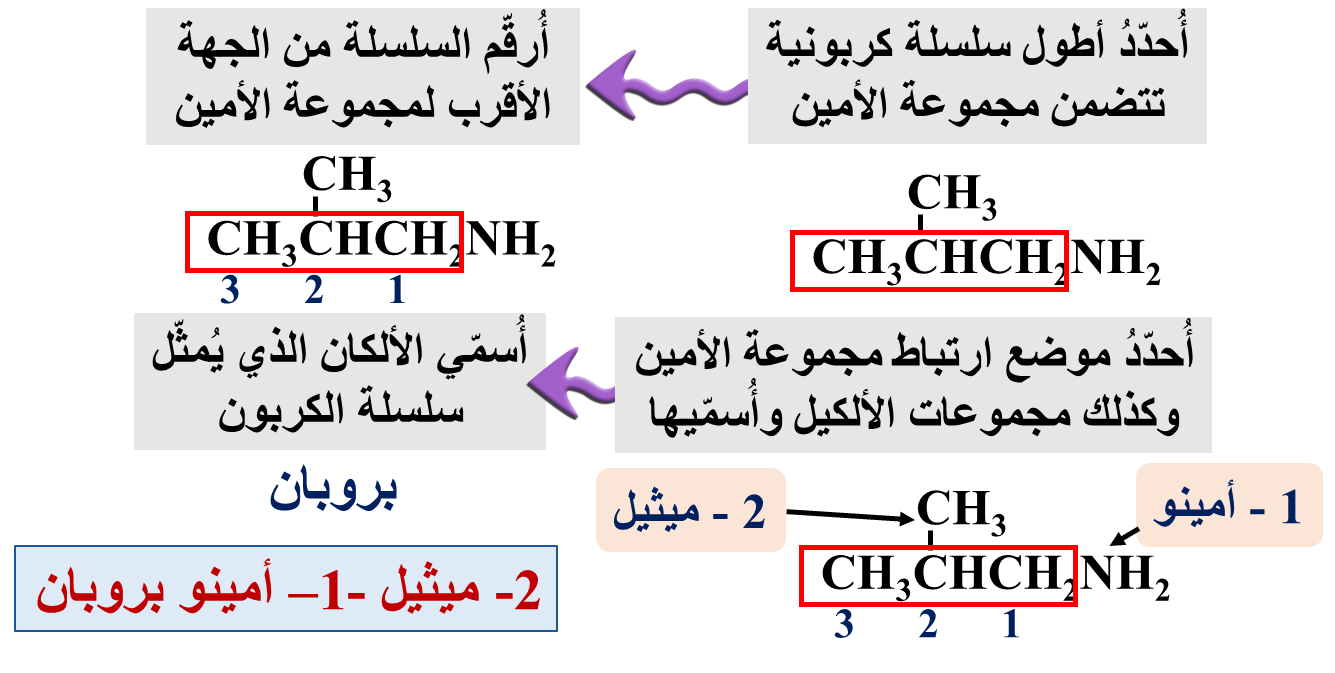
مثال: أُسمّي المُركّب الآتي وفقَ نظام التسمية العالمي .(IUPAC)
CH3CH2CH2NH2
أولًا: أُحدّدُ أطول سلسلة كربونية تتضمن مجموعة الأمين

ثانيًا: أُرقّم السلسلة من الجهة الأقرب لمجموعة الأمين
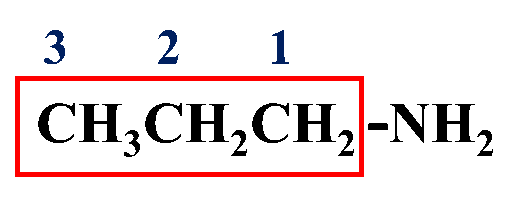
ثالثًا: أكتبُ رقم ذرة الكربون التي تتصل بها مجموعة الأمين تتبعها كلمة أمينو
1 – أمينو
رابعًا: أُسمّي الألكان الذي يُمثّل سلسلة الكربون: بروبان
خامسًا: اسمي المركب كاملًا: 1 – أمينو بروبان
مثال: أُسمّي المُركّب الآتي وفقَ نظام التسمية العالمي .(IUPAC)
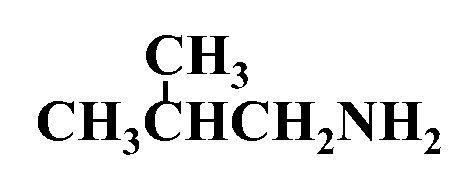
مقارنة درجة غليان بعض الأمينات والألكانات المقاربة لها الكتلة المولية
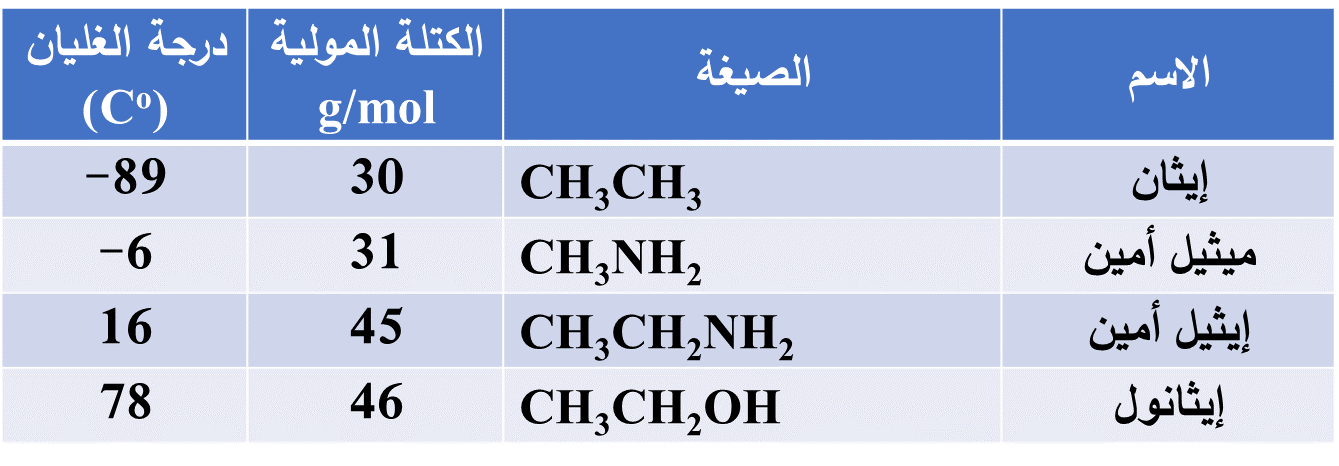
- درجة غليان ميثيل أمين أكبر بكثير منها للإيثان الذي تترابط جزيئاته بقوى لندن الضعيفة مقارنة بالروابط الهيدروجينية بين جزيئات ميثيل أمين
- وعند مقارنة درجات غليان الأمينات معاً تتّضح زيادة درجة غليان الأمين بزيادة عدد ذرات الكربون فيه
- أمّا عند مقارنة درجة غليان الأمين مع الكحول المُقارب له في الكتلة المولية
فيلاحظُ ارتفاعُ درجة غليان الكحول مقارنة بالأمين
وذلك لأن قطبية الرابطة (O-H) أكبر من قطبية الرابطة (N-H)
ذائبية الأمينات في الماء
إنّ ما يفسر ذائبية الأمينات في الماء:
هو قدرة الأمينات الأولية على الترابط مع الماء بروابط هيدروجينيةٍ
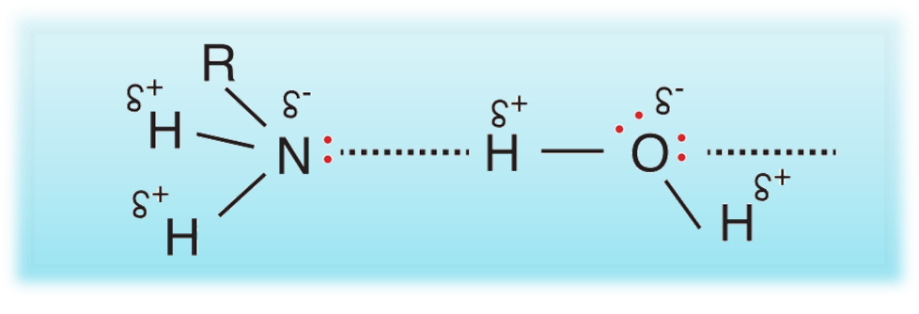
تقلُّ الذائبية بزيادة عدد ذرات الكربون بسبب زيادة تأثير مجموعة الألكيل غير القطبية التي لا تذوب في الماء
إجابات التجربة الاستهلالية (كتاب الأنشطة) - التصاوغ الوظيفي
التحليل والاستنتاج:
1 . أحدد عدد المتصاوغات التي حصلت عليها.
عدد المتصاوغات 7
2. أصنّف المتصاوغات حسب ارتباط ذرة الأكسجين مع باقي الذرات.
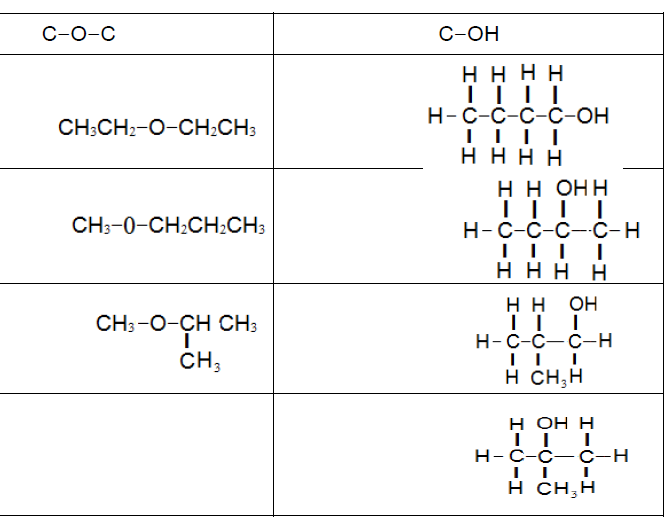
3. أتوقع المتصاوغات المتشابهة في خصائصها الفيزيائية والكيميائية. ُ أبرر توقُّعي.
المتوقع أن تتشابه المركبات التي تحتوي مجموعة ( OH -) في خصائصها، والمركبات التي تحتوي مجموعة ( -O- ) في خصائصها.