- مفهوم التأكسد والاختزال بالإعتماد على الأكسجين :
- اعتمد الكيميائيون قديمًا مفهوم التأكسد إشارةً إلى تفاعل العنصر مع الأكسجين منجًا أكسيد العنصر
- التأكسد (Oxidation) : عملية إضافة الاكسجين إلى العنصر أو المركب
- الاختزال (Reduction) : عملية نزع الأكسجين من المركب.
- تفاعلات التأكسد والاختزال (Oxidation - Reduction Reaction ) :
"هي التفاعلات التي تحدث فيه عمليتان مترافقتان، إحداهما تأكسد والأخرى اختزال"
- مفهوم التأكسد والاختزال بالإعتماد إنتقال الإلكترونات :
- التأكسد : هو فقد الإلكترونات في أثناء التفاعل
- الإختزال : هو إكتساب الإلكترونات في أثناء التفاعل
- نصف تفاعل التأكسد : هي المعادلة التي تظهر فيها الإلكترونات جهة المواد الناتجة
- نصف تفاعل الإختزال : هي المعادلة التي تظهر فيها الإلكترونات جهة المواد المتفاعلة
- العامل المؤكسد : هي المادة التي تختزل وتسبب التأكسد لغيرها.
- العامل المختزل : هي المادة التي تتأكسد وتسبب الاختزال لغيرها .
- ملاحظة (1)
بالرغم من أن التأكسد والإختزال يحدث لذرة واحدة واحدة في المركب أو الأيون متعدد الذرات، إلا أن كامل المركب أو الأيون يسمى العامل المؤكسد أو العامل المختزل وليس ذرة لوحدها
- ملاحظة(2)
إن عدد الإلكترونات المفقودة في نصف تفاعل التأكسد يساوي عدد الإلكترونات المكتسبة في نصف تفاعل الاختزال، لذلك لا تكتب الإلكترونات في معادلة تفاعل التأكسد والإختزال .
- الخلايا الكهركيميائية : (Electrochemical Cells) :
- تعريفها : هي الأدوات التي تحدث فيها تفاعلات التأكسد والاختزال منتجة الطاقة الكهربائية أو مستهلكة لها .
- أقسامها : تقسم الخلايا الكهركيميائية إلى : ( خلايا غلفانية ، خلايا التحليل الكهربائي )
- الخلايا الغلفانية : (Galvanic Cells)
- تعريفها : هي الأدوات التي يحدث فيها تفاعلات تأكسد واختزال يؤديان إلى إنتاج تيار كهربائي، حيث تتحول الطاقة الكيميائية إلى الطاقة الكهربائية
- أشهر الأمثلة عليها : تعد البطاريات أكثر الأمثلة شيوعًا على الخلايا الغلفانية حيث أن جميع البطاريات مثل :
- بطاريات الساعة، الهاتف المحمول، السيارة الكهربائية، فضلًا عن البطاريات المستخدمة في كثير من الأجهزة والألعاب.
- الخلايا الغلفانية البسيطة : (Simple Galvanic Cells) :
* مكوناتها :
1- وعاء يحتوي صفيحتين فلزيتين مغموستين في محلول كهرلي لأحد أملاح الفلز الأقل نشاطًا، حيث تشكل الصفيحتان قطبي الخلية
2- فولتميتر يشير إلى حركة الإلكترونات في الخلية بين الأقطاب ويعطي القراءة التي تمثل قيمة فرق الجهد الكهربائي المتولد في الخلية .
3- أسلاك توصيل تربط بين الأقطاب والفولتميتر .
- بعض المصطلحات المهمة :
- القطب (Electrode) : هو مادة صلبة موصلة في دارة كهربائية ينقل الإلكترونات من المحلول أو المصهور وإليه .
- المحلول الكهرلي (المادة الكهرلية) (Electrolyte): هو مادة تتفكك إلى أيونات موجبة وأخرى سالبة حرة الحركة عند صهرها أو إذابتها في الماء تسمح بمرور التيار الكهربائي .
- المادة غير الكهرلية (Non- Electrolyte) : هي مادة لا تتفكك إلى أيونات حرة الحركة عند صهرها أو ذوبانها في الماء بل تبقى على هيئة جزيئات متعادلة .
- المصعد (Anode) : هو القطب الذي يحدث عليه نصف تفاعل التأكسد ويمثل القطب السالب في الخلية
- المهبط (Cathode) : هو القطب الذي يحدث عليه نصف تفاعل الاختزال ويمثل القطب الموجب في الخلية
- القنطرة الملحية : هي أنبوب على شكل الحرف U يحتوي محلولًا مُشبعًا لأحد الأملاح KCl، وظيفتها المحافظة على التعادل الكهربائي في الخلية.
-
ملاحظة (3) :
يمثل المصعد القطب الذي يحدث عليه تفاعل التأكسد وهو القطب السالب في الخلية وذلك لأنه مصدر الإلكترونات في الخلية .
يمثل المصعد القطب الذي يحدث عليه تفاعل الاختزال وهو القطب الموجب في الخلية وذلك لأن الإلكترونات تتحرك نحوه.
تقل كتلة المصعد لأنه تأكسد وتحولت ذراته إلى أيونات وتزداد كتلة المهبط لأنه اختزل وتحولت أيوناته إلى ذرات
تكون حركة الإلكترونات في الخلية الغلفانية من المصعد إلى المهبط .
-
فرق الجهد الكهربائي في الخلايا الغلفانية المختلفة:
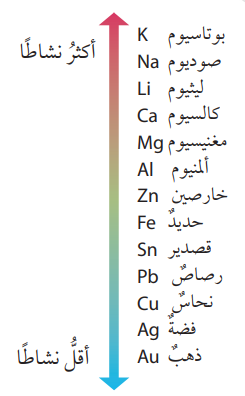
- إن فرق الجهد الكهربائي يعتمد على موقع في سلسلة النشاط الكيميائي حيث أنه :
- كلما زاد الفرق بين الفلزين في النشاط زاد فرق الجهد الكهربائي الناتج من الخلية الغلفانية المكونة منها .
- تطبيقات الخلايا الغلفانية :
1. البطاريات (Batteries) :
- تعد البطاريات مثالًا على الخلايا الغلفانية التي يحدث فيها تفاعل التأكسد والاختزال حيث :
- تتحول الطاقة الكيميائية فيها إلى طاقة كهربائية.
- يوجد أنواع مختلفة من البطاريات منها :
1. البطارية الأولية:: مثل البطارية الجافة 2. البطارية الثانوية : مثل بطارية السيارة
2. خلية الوقود (Fuel Cell)