السؤال الأول :
الفكرة الرئيسية: كيف تنتج الخلايا الجلفانية تيارًا كهربائيًا :
الإجابة :
تتكون الخلية الجلفانية من صفيحتين فلزيتين مغموسين في محلول لأحد أملاح الفلز الأقل نشاط، وجود قطبين لفلزين مختلفين في النشاط يولد فرق جهد كهربائي يدفع الإلكترونات الناتجة عن تأكسد الفلز الأكثر نشاط إلى الى الحركة عبر الأسلاك من المصعد بإتجاه المهبط الذي يمثل قطب الفلز الأقل نشاطًا حيث تختزل أيوناته، وحركة هذه الإلكترونات تمثل التيار الكهربائي الناتج.
السؤال الثاني :
أوضح المقصود بكلٍ مما يأتي :
أ) الخلايا الكهركيميائية ب) المصعد جـ) العامل المؤكسد
الإجابة :
أ) الخلايا الكهركيميائية: هي الأداة التي تحدث فيها تفاعلات تأكسد واختزال وهي منتجة للطاقة الكهربائية أو مستهلكة لها
ب) المصعد : هو القطب الذي تحدث عنه عملية الأكسدة.
جـ) العامل المؤكسد: هي المادة التي يحدث لها عملية اختزال وتسبب التأكسد لغيرها.
السؤال الثالث :
أقارن: أملأ الجدول الآتي الذي يتضمن المقارنة بين التأكسد والاختزال
| التفاعل | التأكسد | الاختزال | ||
| وجه المقارنة | وفقًا لوجود الأكسجين | |||
| وفقًا للإلكترونات |
|
|||
الإجابة :
| التفاعل | التأكسد | الاختزال | ||
| وجه المقارنة | وفقًا لوجود الأكسجين | زيادة عدد ذرات الأكسجين | نقصان عدد ذرات الأكسجين | |
| وفقًا للإلكترونات | فقد اللإلكترونات | كسب الإلكترونات | ||
السؤال الرابع :
أحدد المادة التي تأكسدت والمادة التي اختزلت في المادلة الكيميائية الآتية :
الإجابة :
Zn تأكسد حيث ارتبط بالأكسجين، أيون +Cu2 في CuO اختزل حيث نزع منه الأكسجين.
السؤال الخامس :
أحدد المادة التي تأكسدت والمادة التي اختزلت في نصفي التفاعلين الآتيين :
الإجابة :
في نصف التفاعل الأول: ذرات F، في F2 اختزلت لأنها اكتسبت إلكترونات
في نصف التفاعل الثاني : Cd تأكسد لأنه فقد إلكترونات .
السؤال السادس :
أستنتج العامل المختزل والعامل المؤكسد في المعادلة الكيميائية الآتية :
الإجابة :
Mg: عامل مختزل؛ لأنه قد تأكسد ، +Pb2: عامل مؤكسد لأنه قد اختزل .
السؤال السابع :
وزعت صفائح فلزية للعناصر :( نحاس Cu، رصاص Pb، ألمنيوم Al، خارصين Zn) على مجموعة طلبة في الصف، وطُلب إلى كل مجموعة:
- تشكيل خلية جلفانية بسيطة مختلفة باستخدام زوج من الفلزات ومحلول كهرلي مناسب ( يمكن استخدام أملاح نترات الفضة، إذ أن جميع النترات تذوب في الماء) .
- تنظيم المعلومات الخاصة بالخلية في الجدول التالي :
| قطبا الخلية | المصعد | المهبط | المحلول الكهرلي | اتجاه حركة الإلكترونات من قطب ... إلى قطب ... |
|
|
- الاستعانة بسلسلة النشاط الكيميائي وبالجدول للإجابة عن الأسئلة الآتية :
أ- أستنتج عدد الخلايا الجلفانية التي يمكن تكوينها
ب- أستنتج: أملأ الجدول بحيث يتضمن المعلومات الخاصة بكل خلية
جـ- أُحدد الفلزين اللذين يشكلان قطبي الخلية الجلفانية التي تنتج أعلى فرق جهد كهربائي ثم أبرر اجابتي .
الإجابة :
أ- عدد الخلايا 6 خلايا جلفانية
ب-
| قطبا الخلية | المصعد | المهبط | المحلول الكهرلي | اتجاه حركة الإلكترونات من قطب ... إلى قطب ... |
| Al - Zn | الألمنيوم | الخارصين | نترات الخارصين | من قطب Al إلى قطب Zn |
| Al - Pb | الألمنيوم | الرصاص | نترات الرصاص | من قطب Al إلى قطب Pb |
| Al - Cu | الألمنيوم | النحاس | نترات النحاس | من قطب Al إلى قطب Cu |
| Zn - Pb | الخارصين | الرصاص | نترات الرصاص | من قطب Zn إلى قطب Pb |
| Zn - Cu | الخارصين | النحاس | نترات النحاس | من قطب Zn إلى قطب Cu |
| Pb - Cu | الرصاص | النحاس | نترات النحاس | من قطب Pb إلى قطب Cu |
جـ- الألمنيوم Al والنحاس Cu لأن الألمنيوم أكثر هذه العناصر نشاطًا، والنحاس أقلها نشاطًا .
السؤال الثامن :
خلية جلفانية بسيطة قطباها القصدير Sn والنحاس Cu مغموسان في محلول كهرلي، عند تشغيل الخلية لوحظ أن اتجاه حركة مؤشر الفولتميتر من قطب القصدير إلى قطب النحاس، علمًا بأن القصدير يكون أيون +Sn2 بناءً على ذلك، أُجيب عن الأسئلة الآتية :
أ- أحدد المصعد والمهبط وشحنة كل منهما في الخلية
ب- أقترح المحلول الكهرلي الذي يمكن استخدامه في هذه الخلية
جـ- أكتب نصفي تفاعل التأكسد والاختزال
د- أكتب التفاعل الكلي الذي يحدث في الخلية الجلفانية
هـ- أستنتج التغير في كتلة Sn بعد إنتهاء التجربة
الإجابة :
أ- بما أن مؤشر الفولتميتر تحرك بإتجاه قطب النحاس فإن قطب القصدير Sn هو المصعد وشحنته سالبة وقطب النحاس Cu هو المهبط وشحنته موجبة
ب- يستخدم محلول الفلز الأقل نشاطًا وهو النحاس، فيمكن استخدام محلول نترات النحاس Cu(NO3)2 أو محلول كبريتات النحاس CuSO4
جـ-
د-
هـ- تقل كتلة Sn
السؤال التاسع :
| فرق الجهد الناتج من الخلية (V) | قطبا الخلية | رقم الخلية | |
| فلز 2 | فلز 1 | ||
| 0.1 | B | A | 1 |
| 2.2 | C | A | 2 |
| 1.6 | D | A | 3 |
| 1.9 | C | B | 4 |
الجدول السابق يوضح فرق الجهد الكهربائي الناتج من أربع خلايا جلفانية بسيطة مُكونة من أزواج الفلزات A, B, C, D علمًا أن A أقل هذه الفلزات نشاطًا، وأن جميع هذه الفلزات تكون أيونات شحنتها +2، أتأمله جيدًا، ثم أُجيب عن الأسئلة الآتية :
أ- أستنتج رمز الفلز الأكثر نشاطًا، ثم أُفسر إجابتي
ب- أرتب الفلزات وفقًا لتزايد نشاطها الكيميائي
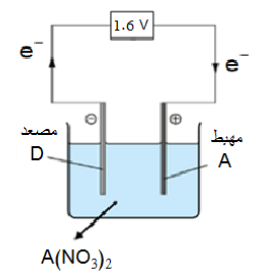
جـ- أرسم خلية جلفانية بسيطة تمثل الخلية (3) ثم أوضح عليها : المصعد، المهبط، والمحلول الكهرلي المقترح، واتجاه حركة الإلكترونات عبر الأسلاك، وقراءة الفولتميتر .
د- أستنتج: أكتب رمز المصعد والمهبط في الخلية B - C
الإجابة :
أ- الفلز C، بالنظر إلى الخلايا الجلفانية 1، 2، 3 ألاحظ أن الفلز A يشكل أحد الأقطاب في كلٍ منها وهو أقل هذه الفلزات نشاطًا، كما أن الخلية المكونة من الفلزين A و C لها أعلى فرق جهد كهربائي وبالتالي يكون الفلز C هو أكثر هذه الفلزات نشاطًا لأنه كلما زاد الفرق بالنشاط بين الفلزين زاد فرق الجهد الناتج في الخلية الجلفانية .
ب- ترتيب الفلزات حسب النشاط : C> D > B > A
جـ-
د- المصعد C، المهبط B