مراجعة الدرس
1. الفكرة الرئيسة: اذكر العوامل التي تعتمد عليها كمية المادة التي تذوب في كمية محددة من الماء.
درجة الحرارة / طبيعة المادة.
2. أملأُ الفراغَ في ما يأتي بالمفهومِ العلميِّ المناسبِ:
1) أكبرُ كمّيّةٍ منَ المذابِ تذوبُ في ( 100 g) منَ الماءِ عندَ درجةِ حرارةٍ معيّنَةٍ تُسمّى الذائبية
2) تُعْرَفُ عمليَّةُ استخلاصِ الأملاحِ منْ محاليلِها للحصولِ على الماءِ والملحِ بِالتقطير
3) المادَّةُ التي تُفكِّكُ جسيماتِ المذابِ في المحلولِ، تُسمّى المذيب
4) يُعبَّرُ عنْ العلاقةِ بينَ كميَّتَيِ المُذابِ والمُذيبِ في المحلولِ بِتركيز المحلول
3. أصفُ عمليّةَ ذوبانِ السكَّرِ في الماءِ.
عند إضافة السكر في الماء تنتشر جسيمات السكر بين جزيئات الماء وتتوزع بانتظام .
4. أصوغُ فرضيَّتي: كيفَ يمكنُ الحصولُ على ماءٍ نقيٍّ منْ محلولِ السكّرِ في الماءِ؟
يمكنني الحصول على السكر من المحلول بتبخير الماء كاملا أو التقطير
5. أقارنُ بينَ تأثيرِ درجةِ الحرارةِ في ذائبيةِ كلٍّ منَ: الموادِّ الصُّلْبةِ والغازاتِ في الماءِ.
تزداد ذائبية المواد الصلبة بزيادة درجة الحرارة ، بينما تقل ذائبية المواد الغازية بزيادة درجة الحرارة.
6. أحسبُ كتلةَ ملحِ كبريتاتِ النحاسِ بالغراماتِ اللازمِ إضافتُها إلى 50mL منْ محلولٍ تركيزُهُ 0.4 g /mL .
m=c×v
m= 0.4×50
m= 20g
7. التفكير الناقد: كيفَ يمكنُني التّأكُّدُ أنَّ المذابَ ما زالَ موجودًا في المحلولِ منْ دونِ أنْ أتذوَّقَهُ؟
بقياس كتلة المواد قبل الذوبان وبعد الذوبان فتكون الكتل متساوية.
تطبيق الرياضيات
1. أُذيبَ ( 30g) منَ الملحِ في كمّيّةٍ كافيةٍ منَ الماءِ، فأصبحَ حجمُ المحلولِ ( 300mL)، أحسُبُ تركيزَهُ.
30/300=c
c= 0.1g/ml
2. أدرسُ الشكلَ المجاورَ، ثمَّ أجيبُ عنِ الأسئلةِ الآتيةِ:
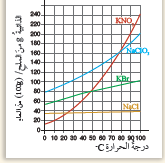
1) ما العاملُ الذي يؤثِّرُ في ذائبيّةِ الأملاحِ؟
درجة الحرارة
2) ما ذائبيَّةُ كلٍّ منْ NaCl ، وَ KBr عندَ درجةِ حرارةِ 80 °C ؟
NaCl = 40
KBr = 85
3) أصفُ ما يحدُثُ لملحِ نتراتِ البوتاسيومِ KNO3 عندَ تبريدِ المحلولِ منْ درجةِ حرارةِ 80 °C إلى 40 °C
تقل ذائبية الملح بانخفاض درجة الحرارة، وتترسب كمية من الملح.
الأنشطة والتمارين
تجربة : مفهومُ الذوبانِ
الموادُّ والأدواتُ:
ماءٌ مقطّرٌ، وملحُ الطعامِ، وسكرُ المائدةِ، ورملٌ، وثلاثُ كؤوسٍ زجاجيّةٍ مرقّمَةٍ سعةُ كلٍّ منْها ( 200ml)، وملعقةٌ صغيرةٌ.
إرشاداتُ السلامةِ:
- أغسلُ يديَّ بعدَ الانتهاءِ منَ التجربةِ.
- أحذرُ تذوُّقَ الموادِّ.
خطواتُ العملِ:
1 . أقيسُ: أضعُ ( 200mL) منَ الماءِ المقطَّرِ في كلِّ كأسٍ على حِدَةٍ.
2. أُضيفُ ملعقةَ ملحِ طعامٍ صغيرةً إلى الماءِ المقطرِ في الكأسِ ( 1)، معَ التحريكِ باستمرارٍ، ثمَّ أُدوِّنُ ملاحظاتي.
3. أكرِّرُ الخطوتينِ السابقتينِ بإضافةِ ملعقةِ سكّرٍ إلى الكأسِ ( 2)، وملعقةِ رملٍ إلى الكأسِ ( 3)، وأُدوِّنُ ملاحظاتي في كلِّ مرَّةٍ.
التحليلُ والاستنتاجُ:
1. أيُّ الموادِّ يمكنُ تمييزُها في المخلوطِ بالعينِ المجرّدةِ؟
الرمل
2. أيُّ الموادِّ انتشرتْ جسيماتُها بينَ جزيئاتِ الماءِ ولا يمكنُ تمييزُها في المخلوطِ؟
السكر والملح
3. ما المقصودُ بالذوبانِ؟
انتشار جسيمات المذاب بانتظام بين جزيئات المذيب.
4. هلْ تذوبُ السوائلُ في الماءِ؟ أصمّمُ -بالتعاونِ معَ زملائي- تجربةً أختبرُ فيها قابليَّةَ ذوبانِ السوائلِ في الماءِ، ثمَّ أُدوِّنُ نتائجَ تجربتي، ثمَّ أناقشُها معَ معلِّمي.
اطلب إلى الطلبة في مجموعاتهم اختبار قابلية ذوبان بعض السوائل في الماء مثل(الخل، الزيت) وتسجيل ملاحظاتهم واستنتاجهم .
تجربة : مفهومُ الذائبيةِ
الموادُّ والأدواتُ: ماءٌ مقطرٌ، وملحُ الطعامِ، وكبريتاتُ النحاسِ CuSO4 ، وسكرُ المائدةِ، وكأسٌ زجاجيةٌ سعتُها ( 200mL )، وملعقةٌ، وميزانٌ إلكترونيٌّ.
إرشاداتُ السلامةِ:
أحذرُ عندَ التعاملِ معَ الكؤوسِ الزجاجيّةِ، وأحذرُ تذوُّقَ الموادِّ، وأغسلُ يديَّ بعدَ الانتهاءِ منَ التجربةِ.
خطواتُ العملِ:
1. أضعُ في إحدى الكؤوسِ الزجاجيّةِ ( 100g) منَ الماءِ المقطّرِ.
2. أقيسُ باستخدامِ الميزانِ الإلكترونيِّ كتلةَ(10g)منْ ملحِ الطعامِ.
3. أُلاحِظُ: أضيفُ ملحَ الطعامِ إلى الماءِ الذي في الكأسِ الزجاجيّةِ، وأُحرِّكُهُ حتى يذوبَ الملحُ تمامًا، وأُكرِّرُ ذلكَ إلى أنْ أُلاحِظَ ظهورَ راسبٍ منْ ملحِ الطعامِ. ما كميّةُ ملحِ الطعامِ التي أُذيبَتْ في الماءِ؟
4. أُجرِّبُ: أُكرِّرُ الخطواتِ باستخدامِ ملحِ كبريتاتِ النحاسِ CuSO4 مرَّةً، وسكّرِ المائدةِ مرَّةً أُخرى.
5. أُدوِّنُ كتلةَ المذابِ التي أُذيبَتْ في الماءِ لكلِّ مادّةٍ عندَ درجةِ حرارةِ الغرفةِ 25 °C ، ثمَّ أُنظِّمُ البياناتِ التي حصلتُ عليها في جدولٍ.
التحليلُ والاستنتاجُ:
1. ما المقصودُ بذائبيّةِ الموادِّ الصُّلْبةِ في الماءِ؟
الذائبية: أكبر كمية من المذاب تذوب في 100g من الماء المقطر عند درجة حرارة معينة.
2. ما أكبرُ كمّيّةٍ منْ ملحِ الطعامِ يمكنُ أنْ تذوبَ في لترٍ منَ الماءِ عندَ درجةِ الحرارةِ نفسِها ؟
لحساب أكبر كمية من ملح الطعام تذوب في لتر من الماء عند درجة حرارة الغرفة:
38g من ملح الطعام تذوب في 100g من الماء
بالضرب التبادلي :
m× 100 = 38× 1000
m= 380g
3. كيفَ يمكنُني إذابةُ المادةِ المترسِّبة؟
عند تسخين المحلول تذوب المادة المترسبة.
تجربة : العواملُ التي تؤثِّرُ في سرعةِ الذوبانِ
أصوغُ فرضِيّتي: كيفَ تُؤثِّرُ مساحةُ سطحِ المادةِ المذابةِ في سرعةِ ذوبانهِا في الماءِ؟
أُدوِّنُ توقُّعاتي: تزدادُ سرعةُ ذوبانِ المادةِ الصُّلْبةِ في الماءِ كلَّما ............... مساحةُ سطحِها الملامسةُ لجزيئاتِ الماءِ.
الموادُّ والأدواتُ: مكعبُ سكّرٍ، وسكّرٌ مطحونٌ خشنٌ، وسكّرٌ مطحونٌ ناعمٌ، وميزانٌ إلكترونيٌّ، وماءٌ في درجةِ حرارةِ الغرفةِ، ومِخْبارٌ مُدرَّجٌ، وكؤوسٌ زجاجيَّةٌ مرقَّمةٌ ( 1، 2، 3) وساعةُ توقيتٍ.
إرشاداتُ السلامةِ:
- أحرصُ على غَسْلِ يديَّ عندَ الانتهاءِ منْ تنفيذِ الخطواتِ.
- أحذرُ عندَ التعاملِ معَ الأدوات الزجاجيّةِ.
خطواتُ العملِ:
1. أقيسُ باستخدامِ المخبارِ المُدرَّجِ ( 100mL ) منَ الماءِ في درجةِ حرارةِ الغرفةِ، ثمَّ أضعُهُ في الكأسِ ( 1).
2. أقيسُ كتلةَ مكعبِ السكّرِ باستخدامِ الميزانِ الإلكترونيِّ، ثمَّ أضعُهُ في الكأسِ.
3. أحسبُ باستخدامِ ساعةِ التوقيتِ الزَّمنَ اللازمَ لذوبانِ مكعبِ السكّرِ كلِّهِ، أفترضُ أنَّها تجربةٌ ضابطةٌ لزمنِ الذوبانِ، ثمَّ أُدوِّنُ هذا الزمنَ في الجدولِ.
4. أكرِّرُ الخطواتِ السابقةَ مستخدمًا الكتلةَ نفسَها منْ سكّرٍ مطحونٍ خشنٍ، ثمَّ سكّرٍ مطحونٍ ناعمٍ.
التحليلُ والاستنتاجُ:
1. أمثِّلُ بيانيًّا بالأعمدةِ النتائجَ السابقةَ التي تمثِّلُ العلاقةَ بينَ الزمنِ اللازمِ للذوبانِ ومساحةِ سطحِ المادةِ الصُّلْبةِ المذابةِ.
2. أفسِّرُ البياناتِ مُحدِّدًا أيَّها استغرقَ زمنًا أقلَّ للذوبانِ في الماءِ.
لأن حجم حبيبات السكر المطحون الصغيرة تكون فيها مساحة السطح المعرضة للذوبان أكبر فتزداد مِساحةُ سطحِ المادّةِ المُذابةِ التي تنتشر بين جزيئاتِ الماءِ، فتزدادُ كمية المذاب كلما قل حجم حبيباته .
3. ما تأثيرُ درجةِ الحرارةِ في زمنِ الذوبانِ؟ أصمّمُ تجربةً لمعرفةِ ذلكَ، ثمَّ أُدوِّنُ ملاحظاتي في جدولٍ.
تزداد الذائبية بزيادة درجة الحرارة يتم توجيه الطلبة إلى الأدوات والمواد التي يمكن أن يستخدموها في تصميم تجربة؛ لاختبار عامل آخر من العوامل التي تؤثر في الذائبية.
تجربة :استخلاصُ الأملاحِ منَ المحلولِ بالتقطيرِ
الموادُّ والأدواتُ: جهازُ تقطيرِ الماءِ، ومحلولُ كبريتاتِ النحاسِ، ورملٌ، وملحٌ، ومخبارٌ مدرَّجٌ، وموقدُ بنسن، ومنْصَبٌ ثلاثيٌّ، وشبكةُ تسخينٍ.
إرشاداتُ السلامةِ: أحذرُ الماءَ الساخنَ في أثناءِ تسخينِ المحلولِ.
خطواتُ العملِ:
1. أقيسُ ( 100mL ) مِنْ محلولِ كبريتاتِ النحاسِ، ثمَّ أضعُ هذهِ الكميّةَ في دورقِ التقطيرِ.
2. أجرِّبُ: أُرَكِّبُ جهازَ التقطيرِ كما في الشكلِ مستعينًا بمعلِّمي.
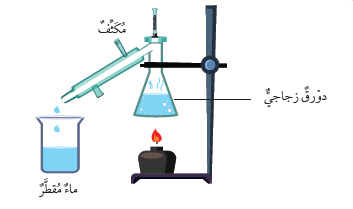
3. أسخِّنُ الدورقَ، حتّى يقاربَ الماءُ في المحلولِ على الانتهاءِ، ويتجمَّعَ في الكأسِ الزجاجيَّةِ.
4. ألاحظُ المادةَ المتبقيةَ في الدورقِ، ثمَّ أُدوِّنُ ملاحظاتي.
التحليلُ والاستنتاجُ:
1. ما العملياتُ التي حدثتْ في جهازِ التقطيv?
التبخر والتكثف
2. ما نواتجُ عمليّةِ التقطيرِ؟
الماء والملح
3. هلِ الماءُ الذي في الكأسِ الزجاجيّةِ نقيٌّ أمْ غيرُ نقيٍّ؟
ماء نقي
4. أستنتجُ: ما أهميّةُ المكثِّفِ في جهازِ التقطيرِ؟
يعمل المكثف عملَ سطح بارد يتكاثف عليه بخار الماء المتصاعد من الدورق.