المركبات الهيدروكربونية المشبعة:
- مقدمة في الكيمياء العضوية:
الكيمياء العضوية أحد أقسام علم الكيمياء، ويهتم بدراسة مركبات الكربون.
اكتسبت المركبات العضوية اسمها، من الاعتقاد القديم، بأن هذه المركبات يمكن الحصول عليها من مصادر حيّة، اعتقاداً منها أن في المخلوقات الحية قوة حيوية تمكنها من إنتاج مركبات الكربون، إلى أن تمكن العالم الألماني فريدريك فوهلر في القرن التاسع عشر من تصنيع مركب عضوي (اليوريا) من مركب غير عضوي (سيانات الأمونيوم)، إلا أن الكيميائيون استمروا في إطلاق تسمية المركبات العضوية على مركبات الكربون، باستثناء أكاسيد الكربون والكربيدات والكربونات.
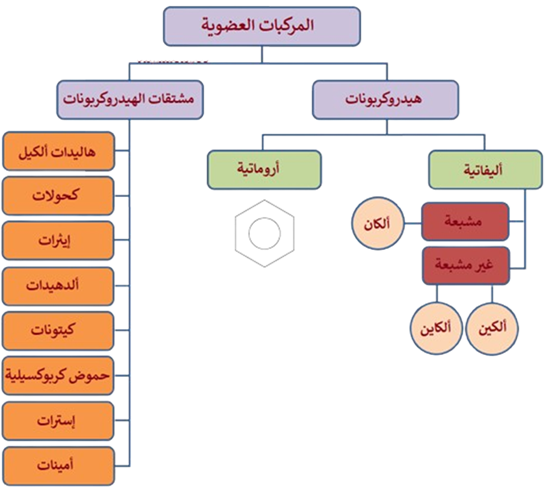
تقسم المركبات العضوية حسب نوع العناصر الداخلة في تركيبها إلى صنفين رئيسين هما الهيدروكربونات ومشتقات الهيدروكربونات، المخطط التالي يبين هذين الصنفين والمركبات العضوية التي تنضوي تحتهما:
الصيغ الجزيئية والصيغ البنائية:
تكتب صيغ المركبات العضوية بطريقتين، تسمى الأولى الصيغة الجزيئية والأخرى الصيغة البنائية.
- الصيغة الجزيئية:
الصيغة الجزيئية: تعبير بالرموز يدل على نوع الذرات وعددها في جزيء المركب.
مثال:
تشير الصيغة الجزيئية إلى أن الجزيء يحتوي على ذرتي كربون و (6) ذرات هيدروجين .
- الصيغة البنائية:
الصيغة البنائية: صيغة تمثل ترتيب الذرات في الفراغ وعلاقاتها داخل الجزيء، وتكتب عادة بشكل مختصر لا تتضح فيه العلاقات الفراغية.
مثال:
تمثل الصيغة الجزيئية بالصيغة البنائية المفصلة الآتية:
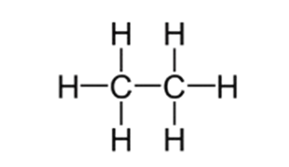
وتبين هذه الصيغة كيف تترتب ذرات الكربون والهيدروجين في الفراغ.
- تصنيف المركبات العضوية :
1- الهيدركربونات :
وهي المركبات التي تحتوي على كربون وهيدروجين فقط، وتشمل:
أ- المركبات الأليفاتية :
وتقسم الى قسمين هما :
الهيدروكربونات المشبعة :
وهي الهيدروكربونات التي تكون جميع الروابط بين ذراتها تساهمية أحادية، وتشمل عائلة الألكانات.
الهيدروكربونات غير المشبعة :
وهي الهيدروكربونات التي تكون تحتوي على رابطة تساهمية ثنائية واحدة على الأقل أو رابطة ثلاثية واحدة على الأقل بين ذرتي كربون متجاورتين، وتشمل عائلتين، هما:
- الألكينات: وهي الهيدروكربونات التي تحتوي على رابطة تساهمية ثنائية بين ذرتي كربون.
- الألكاينات: وهي الهيدروكربونات التي تحتوي على رابطة تساهمية ثلاثية بين ذرتي كربون .
ب- المركبات الأروماتية :
المركبات الأروماتية (العطرية): وهي هيدروكربونات لها رائحة مميزة، وأهمها البنزين.
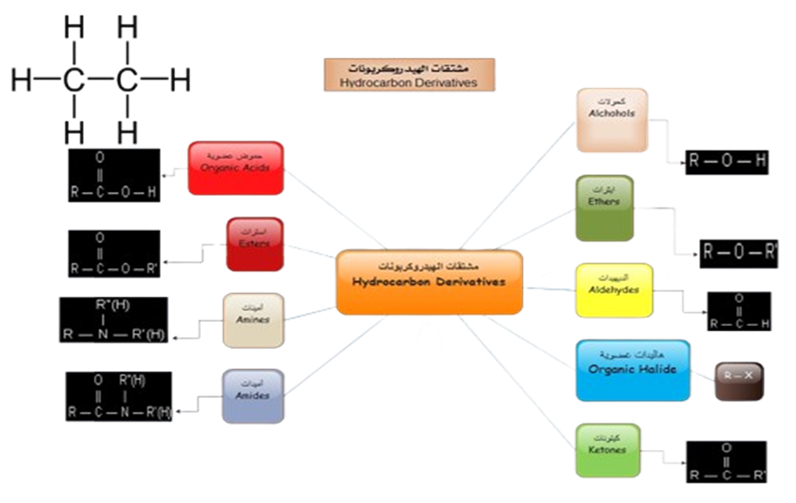
2- مشتقات الهيدروكربونات :
وهي المركبات العضوية التي تحتوي على كربون وهيدروجين، وعناصر أخرى أهمها الأكسجين والنيتروجين والهالوجينات.
تشمل مشتقات الهيدروكربونات العديد من المركبات العضوية، أهمها:
- هاليدات الألكيل.
- الكحولات.
- الإيثرات.
- الألدهيدات.
- الكيتونات.
- الحموض الكربوكسيلية.
- الإسترات.
- الأمينات.
- الألكانات Alkanes :
وهي الهيدروكربونات المشبعة (تحتوي على كربون وهيدروجين فقط، وجميع الروابط بين ذرات الكربون تساهمية أحادية).
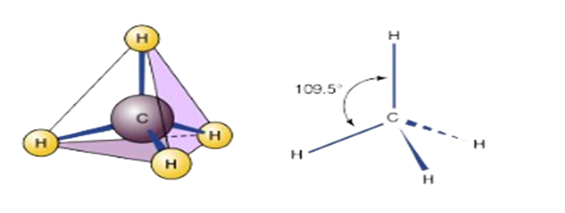
يعتبر الميثان أبسط الألكانات، وشكله رباعي الأوجه منتظم، وتهجين الكربون فيه من نوع ، والزاوية التي تحصر روابطه .
الألكانات ذات السلاسل المستمرة :
تحمل الألكانات ذات السلاسل المستمرة الصيغة الجزيئية العامة:
الألكانات العشرة الأولى، وصيغها الجزيئية والبنائية المختصرة.
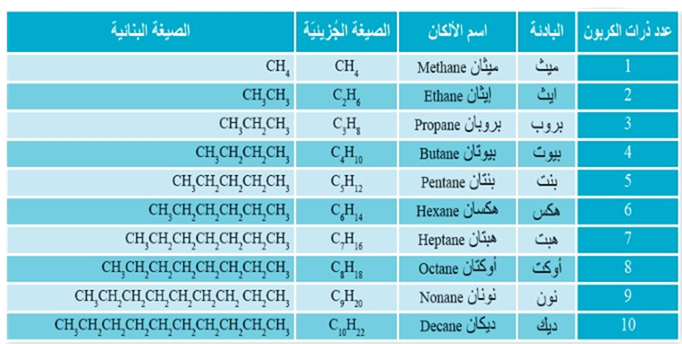
يتكون اسم الألكان من مقطعين ، الأول "الك" يدل على عدد ذرات الكربون الثاني "آن" يدل على حالة إشباع المركب .
الألكانات المتفرعة:
اعـتمد الاتحاد الدولي للكيمياء البحتة والتطبيقية (الأيوباك) IUPAC طريقة لتسمية مركبات العضوية تعرف بالتسمية النظامية.
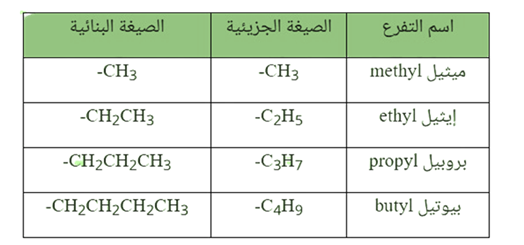
اسماء التفرعات (مجاميع الألكيل -R):
تحمل التفرعات المرتبطة بسلسلة الألكان الصيغة الجزيئية العامة وتعرف التفرعات أيضاً باسم مجاميع الألكيل، وتشتق صيغها بنزع ذرة هيدروجين من الألكان.
قواعد تسمية الألكانات المتفرعة:
- اختر أطول سلسلة كربونية متتابعة.
- رقم السلسلة من الطرف الأقرب للتفرع
- سم التفرع مسبوقاً برقم ذرة الكربون المرتبطة به
- إذا احتوت السلسلة على أكثر من تفرع متشابه، اكتب أرقام ذرات الكربون المرتبطة بالتفرعات ثم كلمة ثنائي أو ثلاثي أو رباعي ... حسب عددها، ثم اسم التفرع.
- إذا احتوت السلسلة على أكثر من تفرع مختلف، سم كل تفرع مسبوقاً برقم ذرة الكربون المرتبطة به، ويتم البدء بتسمية التفرعات هجائياً باللغة الإنجليزية. مثلاً تسمى مجموعة الإيثيل (CH2CH3) قبل مجموعة الميثيل (CH3).
- سمّ السلسلة الكربونية الطويلة حسب عدد ذرات الكربون فيها كما تسمى الألكانات غير المتفرعة.
- ملاحظة : يفصل الرقم عن الحرف الهجائي (-)، والرقم عن الرقم (،).
مثال:
أسمّي المُركِّب الآتي وفقَ نظام التسمية العالمي
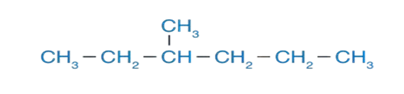
الحل:
1 - أحدّد أطول سلسلة مُستمرّة من ذرّات الكربون، وأُسمّيها.
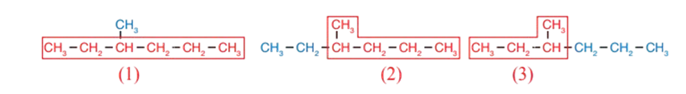
يتّضحُ ممّا سبق أن هناك ثلاث سلاسل، أختار منها السلسلة (1) التي تحتوي على ستّ ذرّات كربون، وتُسمّى هكسان، فهي أطول سلسلة لأنّها تحتوي على أكبر عدد من ذرّات الكربون.
2 - أُرقّم ذرّات الكربون في السلسلة الأطول كما يأتي:
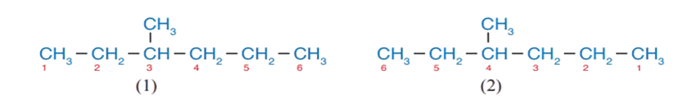
أختارُ الشكل (1)؛ لأنّهُ يعطي أقلّ الأرقام لمجموعة الميثيل؛ فحسب نظام التسمية العالمي يجب أن يبدأ ترقيم ذرّات الكربون في السلسلة الأكثر طولا من الطرف الأقرب للتفرُّع؛ لأن رقم مجموعة الميثيل فيه هو 3 وليس 4 .
3 - أُسمّي كُلّ تفرّع، وأضع الاسم قبل اسم السلسلة الرئيسة، وبما أنه لا يوجد سوى تفرّع واحد هو الميثيل ، أضع اسمه قبل اسم الألكان ، فيصبح ميثيل هكسان .
4۔ أكتب رقم التفرع واسمه : 3- ميثيل
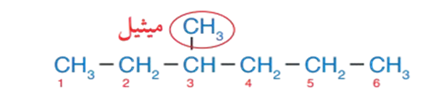
5- أكتب اسم المُركّب كاملًا فيصبح: 3- ميثيل هكسان. ألاحظ أنّ طريقة كتابة اسم المُركّب يمكن أن تكون على الصيغة العامة: رقم التفرّع - اسم التفرّع اسم الألكان.
مثال:
أسمّي المُركِّب الآتي وفقَ نظام التسمية العالمي (IUPAC). .
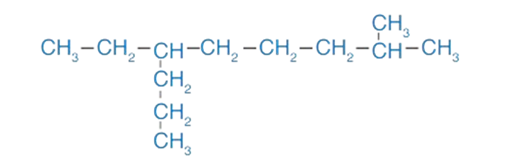
الحل:
1 - أحدّد أطول سلسلة مستمرة من ذرّات الكربون، وأُرقّمها من الجھة الأقرب لأول تفرّع.
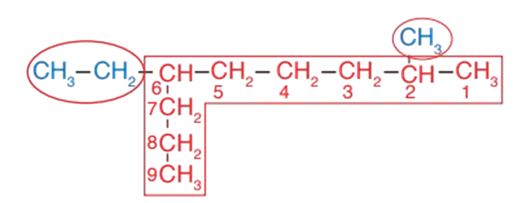
2 - أُعطي أرقامًا وأسماء للتفرّعات، حيث يقع التفرّع الأول على ذرّة الكربون رقم 2؛ ويقع التفرّع الثاني على ذرّة الكربون رقم 6، وبما أن التفرّعين غير متشابهين (ميثيل وإيثيل)، واعتمادًا على اللغة الإنجليزية؛ فإنّ إيثيل تسبق ميثيل؛ لذا فإنّ 6- إيثيل تُكتَب في الاسم قبل 2- ميثيل ، فيصبح على النحو الآتي: 6- إيثيل -2- ميثيل .
3 - أكتب في نهاية الألكان الاسم الذي يُمثّل السلسلة الأكثر طولًا، وهو نونان، فيصبح اسم هذا المركب : 6- إيثيل -2- ميثيل نونان
مثال:
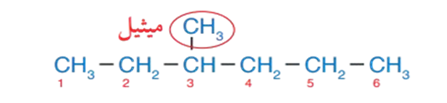
أكتب الصيغة البنائية للمركب 3،2،2- ثلاثي ميثيل هبتان .
الحلُّ:
1 - أرسم سلسلةً مستمرّةً من ذرّات الكربون مُكوّنةً من 7 ذرّات كربون تُمثّل اسم الألكان، وأُرقّمها كما في الشكل الآتي:
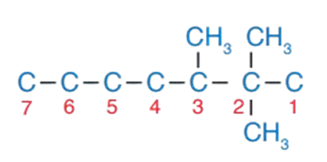
2 - أضعُ مجموعَتي ميثيل على ذرّة الكربون رقم 2 والمجموعة الثالثة على ذرة الكربون رقم 3 كما في الشكل :
3 - أضيفُ ذرّات الهيدروجين إلى ذرّات الكربون، بحيث تُكوّن كلّ ذرّة كربون أربع روابطَ مع ذرّات الهيدروجين؛ فيصبح الشكل النهائي كالآتي:
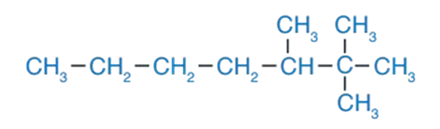
- المتصاوغات Isomers :
هنالك مركبات عضوية تشترك معاً في الصيغة الجزيئية وتختلف في الصيغة تسمى تلك المركبات المتصاوغات، وتسمى هذه الظاهرة بالتصاوغ.
التصاوغ: وجود صيغ بنائية مختلفة للصيغة الجزيئية نفسها.
المتصاوغات البنائية :
المتصاوغات البنائية: اختلاف ترتيب ذرات الكربون في الألكان عن السلسلة المستمرة.
مثال:
أرسمُ متصاوغات الصيغة الجُزيئيّة وأسمّي كُلَّا منها.
الحلُّ:
1 - أرسم خمس ذرّات كربون في سلسلة مستمرة C-C-C-C-C
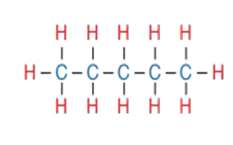
2 - أوزّع ذرّات الهيدروجين على ذرات الكربون بحيث تكون كل ذرة كربون اربع روابط تساهمية أحادية كما في الشكل المجاور ، ويكون الاسم بنتان .
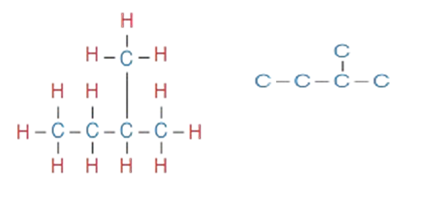
3 - أرسم أربع ذرّات كربون في سلسلة مستمرة وأربط ذرّة الكربون الخامسة على إحدى ذرّتي الكربون في داخل المُركّب، وليس على الأطراف.
4 - أوزّع ذرّات الهيدروجين على ذرّات الكربون ، بحيث تُكوِّن كلّ ذرّة كربون أربع روابط تساهمية أُحادية في الشكل المجاور، ويكون الاسم 2- ميثيل بيوتان.
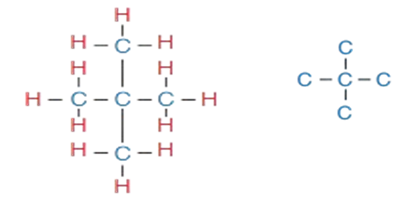
5 - أرسم ثلاث ذرّات كربون في سلسلة مستمرة، وأربط ذرّتي الكربون المتبقّيتين مع ذرّة الكربون الثانية في السلسلة.
6 - أوزّع ذرّات الهيدروجين على ذرّات الكربون؛ بحيث تكوّن كلّ ذرّة كربون أربع روابطَ تساهمية أُحادية كما في الشكل المجاور، ويكون الاسم 2،2- ثنائي ميثيل بروبان
(ويمكن اختصار الاسم في هذه الحالة إلى: ثنائي ميثيل بروبان؛ لأنّ التفرّع سيكون على ذرّة الكربون الثانية).
الخصائص الفيزيائية والكيميائية للألكانات :
- الألكانات مركبات غير قطبية.
- ترتبط جزيئاتها بقوى لندن.
- لا تذوب في الماء، وتذوب في المذيبات غير القطبية.
- درجات غليانها منخفضة، وتزداد درجات غليانها بازدياد الكتلة المولية (عدد ذرات الكربون).
أولاً: الخصائص الفيزيائية :
أول أربع ألكانات (ميثان - بيوتان) غازات، والتي تحتوي من 5 - 16 ذرة كربون سوائل، وما بعد ذلك ألكانات صلبة.
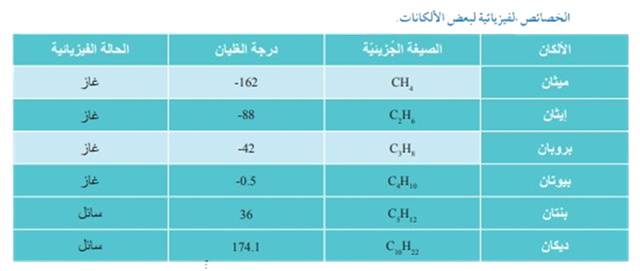
يبين الجدول الخصائص الفيزيائية لبعض الألكانات، حيث تكون الألكانات الأربعة الأولى غازيةً؛ في حين تصبح سائلة من البنتان إلى الألكان الذي يحتوي على 16 ذرّة كربون، وتصبح صلبة في الألكانات التي تحتوي على أكثر من 16 ذرّة كربون، ويلاحَظ
أن درجة الغليان تزداد بزيادة عدد ذرات الكربون أي بزيادة الكتلة المولية للألكان ، وذلك بسبب زيادة قوى لندن .
ثانياً: الخصائص الكيميائية :
تمتاز الألكانات بأنها مستقرة نسبياً، وذلك لقوة الروابط الأحادية بين الكربون والهيدروجين، إذ تحتاج لطاقة عالية لكسرها، ومن أهم تفاعلات الألكانات:
الاحتراق :
تحترق الألكانات بوجود الأكسجين وينتج من احتراقه غاز ثاني أكسيد الكربون وبخار الماء وكمية من الطاقة.
مثال :
تفاعل احتراق الميثان CH4 والبروبان C3H8
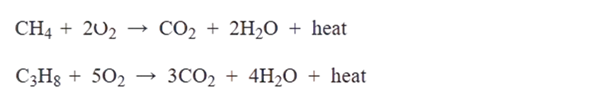
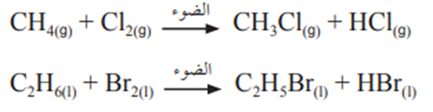
الهلجنة :
تتفاعل الألكانات مع الهالوجينات بوجود الضوء كعامل مساعد، وفيه تحل ذرة هالوجين أو أكثر محل ذرة هيدروجين أو أكثر في الألكان.
مثال :
تفاعل هلجنة الميثان CH4، والإيثان C2H6